Monografías
Monografías 2024
Cuidados paliativos en Unidad Coronaria: abordaje integral del paciente crítico y su repercusión en el personal de salud.


Autora: Dra. Bárbara Denise Kehoe.
Matrícula N° 178499
Residencia: Sanatorio de la Trinidad Mitre
Año: 2024
Año: 2024
Introducción
La Unidad Coronaria (UCO) surge históricamente en el marco de la prevalencia significativa y en aumento del infarto agudo de miocardio con complicaciones severas en personas jóvenes, para su abordaje precoz y agresivo, previniendo así la muerte súbita por arritmias malignas y sus complicaciones mecánicas a corto plazo. Con el devenir del desarrollo científico y técnico, fue incluyéndose el abordaje de otra serie de patologías cardiovasculares de instalación aguda con alta mortalidad (síndromes aórticos, tromboembolismo pulmonar, arritmias primarias).1,2
El imperativo terapéutico es el principio rector sobre el cual se forman los especialistas en esta materia, ya que la implementación de estrategias intensivas redujo sustancialmente la mortalidad cardiovascular en los últimos 60 años. A pesar de esto, los pacientes admitidos en la UCO aún presentan una mortalidad significativamente alta, por lo que el personal de salud se enfrenta cotidianamente al desafío de acompañar a pacientes críticos con riesgo de vida o en condiciones de fin de vida, independientemente de si se trata de una patología aguda o crónica (ver Figura 1).3
Interesa destacar que pueden presentarse condiciones clínicas distintas que plantean a priori dos estrategias de intervención y sobre las cuales la capacidad anticipatoria difiere. 4 Por un lado, la instalación abrupta de una patología grave (por ejemplo, un infarto anterior extenso Killip D), que requiere una intervención agresiva por parte del equipo de salud, dirigiendo gran parte de la conducta médica a su resolución y que, en el contexto de la urgencia, puede no dejar margen al diálogo adecuado con el paciente y su familia sobre la posibilidad de muerte y las decisiones alrededor de esta. En muchos casos, el estado general del paciente no permite tratar directivas anticipadas.
Por otro lado, la patología crónica con compromiso del paciente en el mediano-largo plazo, con internaciones subsecuentes y deterioro del estado funcional progresivo hasta su muerte. El ejemplo clásico es la insuficiencia cardíaca (IC) crónica, donde la estrategia terapéutica suele orientarse a disminuir las reinternaciones sistemáticas, que implican un pronóstico desfavorable y aumento de la mortalidad sustancial.4
Las hipótesis de este trabajo se centran en la cotidianidad de la praxis médica y su relación tanto con el paciente como con su entorno en el marco de la patología crítica con alta mortalidad en la Unidad Coronaria: ¿tenemos alguna forma de aliviar y acompañar al paciente que presenta riesgo de vida, además del tratamiento específico? ¿Cuáles son esas herramientas? ¿Cómo afecta al personal de salud la muerte de los pacientes?
El objetivo principal de este trabajo es estudiar las barreras para el acompañamiento médico integral en pacientes críticos de la Unidad Coronaria y proponer medidas concretas para superarlas. Como objetivo secundario, se busca valorar el impacto en el personal de salud (burnout) como un determinante clave de la dificultad en el abordaje integral del pa(de)ciente.
Metodología: materiales y métodos
Para la realización de esta monografía, se utilizaron las recomendaciones y normas de los profesionales a cargo de la coordinación de la carrera de especialista en Cardiología de la Universidad de Buenos Aires del año 2023 y la bibliografía sugerida por ellos.
La búsqueda se realizó con base en publicaciones científicas en MedLine, PubMed, Cochrane y revistas de sociedades científicas de Cardiología hasta enero de 2023, e inició a partir de palabras clave como cuidados de fin de vida, historia, normativa y estadística regional de cuidados paliativos, cuidados paliativos en Unidad Coronaria, limitación terapéutica, tratamiento sintomático y sus respectivas traducciones al idioma inglés. La búsqueda se completó con base en referencias cruzadas a partir de la bibliografía inicialmente consultada. Los ensayos se obtuvieron de publicaciones científicas en internet. Se incluyeron artículos publicados en el período comprendido entre los años 1990 y 2023.
Desarrollo
- Historia y definiciones
El desarrollo de un servicio de cuidados paliativos (CP) en Latinoamérica se impulsa alrededor de la década de 1980, vinculado con la promoción de la campaña de “Alivio del dolor por cáncer” de la Organización Mundial de la Salud (OMS) en 1982. En Argentina, Roberto Wenk, médico anestesiólogo, quien inicialmente prestaba CP domiciliarios, creó el Programa Argentino de Medicina Paliativa en la Liga Argentina de la Lucha contra el Cáncer en San Nicolás; otros de los referentes fundamentales fueron el Dr. Eduardo Bruera1 y el Dr. Álvaro Sauri.2 En 1992 se crearon equipos de CP pediátricos en el Hospital Gutiérrez y Hospital Garrahan, siendo una de sus fundadoras la Dra. Rosa María Germ;35 en 1994, la Fundación FEMEBA y el Programa Argentino iniciaron un programa de asistencia, educación e investigación en CP. En ese mismo año, se creó la Asociación Argentina de Medicina y Cuidados Paliativos, y en 2001 se fundó la Asociación de Cuidados Paliativos de Latinoamérica.5
Actualmente, nuestro país se considera dentro de los países de ingreso mediano-alto de la región de acuerdo con la clasificación del Banco Mundial según ingresos hasta el año 2020, con adecuada capacidad de respuesta ante las necesidades en torno a la salud paliativa: Argentina cuenta con la mayor cantidad de equipos de CP en toda Latinoamérica y con una distribución de opioides (DOME)4 aceptable (ver Figura 2), siendo el segundo país en este aspecto luego de Brasil. Asimismo, presenta una relación entre reguladores y prescriptores “buena” a nivel nacional.5 A diferencia de otros países de la región que presentan marco regulatorio desde hace más de 15 años, siendo el más antiguo el de Costa Rica (1998), se cuenta con una Ley Nacional recientemente promulgada (Ley Nacional N° 26.678, julio del 2022)6 con su respectivo decreto reglamentario, dictaminado en junio de 2023, a pesar de lo cual aún se encuentran sin definición aspectos claves de esta, por ejemplo, la financiación de las medidas que implique su implementación.
Una de las dificultades para la implementación de CP en los pacientes de UCO se origina en su definición. La idea colectiva actual de estos surge no solo de la semántica
1 Bruera, Eduardo. Médico oncólogo graduado en Rosario, terminó su formación profesional como oncólogo en Canadá. Colaborador de la OMS y OPS en desarrollo de CP en Latinoamérica y el Caribe.
2 Sauri, Álvaro. Médico oncólogo. Fundador de la Asociación Argentina de Cuidados Paliativos. Jefe de departamento de Cuidados Paliativos del Insituto de Oncología Angel H. Roffo.
3 Germ, María Rosa. Médica pediatra, fundadora de CP pediátricos. Actualmente, coordinadora de CP pediátricos en el Htal. Pediátrico J. P. Garrahan.
4 La distribución de opioides equivalentes de morfina (DOME, por sus siglas en inglés) ha sido reconocida como indicador del acceso a CP por su importancia en el tratamiento sintomático.
(“paliativo” como alternativa de mitigar el daño de una enfermedad sin resolverla completamente), sino del propio devenir histórico, centrado en las limitaciones científico-técnicas que existían cuando surgió la disciplina. Esta surgió para acompañar y mitigar el sufrimiento en pacientes oncológicos, por el pronóstico desfavorable y ominoso que representaba el diagnóstico en ese momento.3 La construcción de una definición unificada y consensuada es necesaria para poder comprender sus límites y, con ello, su indicación con mayor claridad.7
La definición de la Organización Mundial de la Salud (OMS) en 2002 sobre CP8 los describe como “la asistencia activa y holística de personas de todas las edades con sufrimiento severo relacionado con la salud, debido a una enfermedad grave, y especialmente quienes se encuentran cerca del final de la vida, mejorando la calidad de vida de estos pacientes, sus familias y cuidadores. Estos, a su vez:
- Incluyen prevención, identificación precoz, evaluación integral y control de problemas físicos (dolor y otros síntomas angustiantes), sufrimiento psicológico, sufrimiento espiritual y necesidades sociales. Siempre que sea posible, estas intervenciones deben estar basadas en la evidencia.
- Brindan apoyo a los pacientes para vivir lo mejor posible hasta la muerte, facilitando la comunicación efectiva, ayudándoles a ellos y a sus familias a determinar los objetivos de la asistencia.
- Son aplicables durante el transcurso de la enfermedad, de acuerdo con las necesidades del paciente.
- Se proporcionan conjuntamente con tratamientos que modifican la enfermedad, siempre que sea necesario.
- Pueden influir positivamente en el curso de la enfermedad.
- No pretenden acelerar ni posponer la muerte, afirman la vida y reconocen la muerte como un proceso natural.
- Brindan apoyo a la familia y a los cuidadores durante la enfermedad de los pacientes y durante su propio duelo.
- Se proveen reconociendo y respetando los valores y creencias culturales del paciente y de la familia.
- Son aplicables en todos los ambientes de atención médica (sitio de residencia e instituciones) y en todos los niveles (primario a terciario).
- Pueden ser provistos por profesionales con formación básica en CP.
- Requieren CP especializados con un equipo multiprofesional para la derivación de casos complejos.”
Los CP pueden brindarse en diferentes ámbitos: a nivel extrahospitalario, de forma domiciliaria, en centros de atención primaria de salud o en hospicios; y a nivel intrahospitalario. En el contexto intrahospitalario, pueden prestarse en Unidades de Cuidados Paliativos (UCP), Equipos Móviles y Unidades Mixtas (ver Glosario).
De acuerdo con la OMS y la Organización Panamericana de Salud (OPS), el objetivo de los CP es aliviar y mejorar la calidad de vida de una persona con sufrimiento serio relacionado con la salud, aplicable a todos los pacientes, independientemente de su diagnóstico, pronóstico, ámbito de cuidado, localización geográfica y nivel socioeconómico. El sufrimiento serio relacionado con la salud se define como aquel que se encuentra vinculado con enfermedad o lesión de cualquier tipo; es moderado a severo cuando compromete el funcionamiento físico, social o emocional, y no puede ser aliviado sin la intervención de un profesional de la salud. Los CP, entonces, se orientan a pacientes con sufrimiento serio relacionado con la salud o que se encuentren en situación de fin de vida.9
Es clave distinguir los conceptos fundacionales, ya que esto clarifica la indicación en los pacientes que deberían recibir este tipo de atención y en quiénes se debería planificar su aplicación de manera anticipada (ver Glosario).10 A diferencia del concepto popularmente conocido, limitante en cuanto a la indicación precoz de los CP, con la definición de la OMS en 20026 y, posteriormente, la redefinición consensuada a nivel internacional en 2017,7 se traza un nuevo horizonte terapéutico para los pacientes portadores de patología cardiovascular, ya sea aguda o crónica (ver Figura 3).
Glosario
- Cuidados de fin de vida: utilizado de diversas formas, ya sea para significar la atención terminal de pacientes moribundos y/o también de manera intercambiable como “cuidados paliativos”. Los cuidados al final de la vida pueden comenzar tan pronto como se diagnostique una enfermedad irreversible y progresiva.10
- Cuidados Paliativos Cardiológicos (CPC): aquellas conductas en el marco de los CP
que debe tomar el equipo de cardiología clínica.5
- Cuidados paliativos primarios: aquellos que son prestados por el personal de salud no especializado en el tema o cuidadores/voluntarios. Dentro de estos, se incluyen médicos de otras especialidades (clínicos, cardiólogos, generalistas, etc.).9
- Cuidados paliativos secundarios/especializados: aquellos prestados por especialistas
en CP.10
5 Si bien la definición no se toma explícitamente de ninguna bibliografía, se interpreta de su aplicación en los textos. Se utilizará de esta manera a lo largo del desarrollo del trabajo.
- Cuidados paliativos: modelo de atención destinado a mejorar la calidad de vida de pacientes y familias que se enfrentan a los problemas asociados con enfermedades que amenazan o limitan la vida, a través de la prevención y alivio del sufrimiento, por medio de la identificación temprana, evaluación y tratamiento del dolor y otros problemas, físicos, psicológicos, sociales y espirituales.9
- Cuidados terminales: atención durante los últimos días o semanas de la vida del
paciente. 10
- Directivas anticipadas: indicaciones del paciente sobre su deseo de no ser sometido a intervenciones que no brindan curación, modifican la evolución o proporcionan mejoría sintomática. Deben constar por escrito.6,11
- Enfermedades amenazantes y/o limitantes para la vida: aquellas en las que existe
riesgo de muerte. En general, se trata de enfermedades graves y/o crónicas complejas, progresivas y/o avanzadas que afectan significativamente la calidad de vida de quien las padece y la de su familia.6
- Entorno significativo: personas que atienden las necesidades físicas y emocionales
de un enfermo, por lo general su pareja, hijo, hija, un familiar o persona cercana. En conjunto con el/la paciente, forman la unidad terapéutica de CP.6
- Equipo móvil: operan en hospitales de segundo y tercer nivel sin camas asignadas en
un espacio físico determinado (‘móviles’). Estos equipos pueden tener la posibilidad de hospitalizar en camas de otros servicios dentro del hospital y ser el equipo tratante o hacer recomendaciones e interconsultas.5
- Hospicios: instituciones independientes dedicadas a pacientes de media y larga
estancia y/o cuidados hasta el fallecimiento. Tienen un sistema de referencia con hospitales de segundo y/o tercer nivel. 5
- Unidades de Cuidados Paliativos (UCP): espacio dedicado exclusivamente para CP
con personal y camas asignadas al servicio, que tiene como objetivo la atención de pacientes con problemas agudos o de resolución compleja, pueden prestar servicio de interconsulta y consulta externa.5
- Unidades mixtas: los equipos mixtos son unidades de cuidados paliativos o
equipo/unidad móvil que cumplen los requisitos anteriores y, adicionalmente, se desplazan fuera del hospital con consulta domiciliaria o en consultorios comunitarios.5
- Cuidados paliativos en Cardiología y en la Unidad Coronaria
Epidemiología
La primera causa de mortalidad por enfermedades no transmisibles (ENT) a nivel mundial continúa siendo la cardiovascular (CV). Con el aumento de la prevalencia global de las enfermedades cardiovasculares (ECV), se hace imprescindible considerar la calidad de vida y las experiencias al final de la vida de quienes las padecen, que presentan trayectorias de enfermedad y experiencias de sufrimiento únicas.
En nuestro medio, las muertes por ECV representaron un 42,2% del total de las ENT y 24,6% de todas las muertes ocurridas en 2021; esta cifra se mantuvo estable los últimos diez años. De estas, el primer subgrupo más frecuente de causas de muerte fue el de insuficiencia cardíaca, que representó un 26% del total. El segundo subgrupo fueron las enfermedades isquémicas con un 23,1% (ver Figura 4).1 2 Estos datos suponen una elevada carga de morbimortalidad cardiovascular, que a su vez implica una utilización de recursos sanitarios de fin de vida equiparables a la de pacientes oncológicos. De hecho, algunos autores plantean la equivalencia de la insuficiencia cardíaca (IC) con las condiciones malignas, basándose en la carga de síntomas y mortalidad. Ambas patologías presentan similitudes en las necesidades de CP que son genéricas, como síntomas complejos refractarios, requerimiento de comunicación asertiva con el fin del acompañamiento familiar y el proceso de toma de decisión.10 A pesar de comprender su severidad en estos términos, sólo un número comparativamente pequeño de pacientes con IC recibe cuidados paliativos especializados, y es llamativamente prolongado el tiempo que transcurre hasta su incorporación.13 De acuerdo con lo recabado por Slavin y cols., los cardiólogos remiten a sus pacientes al servicio de CP con menor frecuencia que otras especialidades y de manera tardía en la enfermedad. Incluso se vio que las remisiones se redujeron y que, dentro de la población estudiada, un tercio de los pacientes se encontraban postrados al momento de la interconsulta.13
Dificultades en el acceso
Ciertas barreras para recibir CP en el contexto de la patología cardiovascular dependen de su evolución y del ámbito de atención.
En el contexto de internación en sala general cardiológica o en UCO, la incertidumbre relacionada con la ECV no solo afecta a los pacientes, sino también a los médicos, ya que es difícil saber cuál será el grado de recuperación o si será completa al estado previo a la admisión. Otros obstáculos son la reticencia de los profesionales de la salud para abordar la muerte y el proceso de morir, la idea de que los CP y el tratamiento específico son excluyentes entre sí; el impacto que presenta la muerte en el personal de salud en conjunto
con la elevada carga horaria y laboral que confrontan (ver Burnout), lo cual impacta en su identificación.3 Existen estudios que resaltan la falta de formación en CP primarios y de entrenamiento en la comunicación como grandes limitaciones.4,14
Cuando el estado general del paciente no permite su consentimiento, este debe ser dado por su entorno, lo cual puede presentarse como un obstáculo, particularmente en el momento de discontinuación de terapias de sostén hemodinámico en pacientes sin mejoría clínica.3,15
En el contexto ambulatorio, las limitaciones se tratan fundamentalmente de la imprevisibilidad de las condiciones vinculadas a descompensaciones recurrentes, la dificultad para anticipar la fase terminal y la elevada prevalencia de muerte súbita en pacientes con cardiopatía avanzada. En el documento de posición de la Sociedad Europea de Cardiología (ESC) sobre los CP en pacientes con IC, se plantea la dificultad de indicarlos porque existe un espectro de la enfermedad demasiado extenso según su estratificación.10 Sin embargo, también pone de manifiesto la necesidad de realizar un acercamiento global al paciente, considerar los potenciales efectos adversos y complicaciones de los tratamientos (farmacológicos, colocación y funcionamiento de dispositivos e intervenciones), la progresión de los síntomas y pronóstico, en función de lo cual se planteará este abordaje en mayor o menor medida (ver Figura 4).13
Independientemente del contexto, se evidencia una tendencia de los pacientes y cuidadores a equiparar el alivio de los síntomas con los CP como un proceso que acelera o asume la muerte.16
Interesa destacar que los CP primarios son un enfoque aplicable a todos los entornos de atención y no dependen de un equipo de atención médica específico. En este sentido, no debería reservarse únicamente para los pacientes que tienen un mal pronóstico a corto plazo, sino que deben estar disponibles para todos aquellos pacientes que necesiten un tratamiento integrado a lo largo de la trayectoria de su enfermedad.: De acuerdo con la OMS, el enfoque de CP no es menos aplicable en etapas tempranas de la ECV en paralelo con las opciones de tratamiento específico.10
Personal de salud en cuidados críticos: burnout
El síndrome de burnout (SBO) se define como un estado de desgaste mental y físico determinado por tres dimensiones principales: agotamiento emocional, despersonalización (lo cual incluye negatividad, cinismo y la incapacidad para expresar empatía o dolor) y falta de realización personal.17,18 Se presenta como una respuesta al estrés laboral que se desarrolla en forma progresiva que eventualmente puede volverse crónica.19
El SBO afecta el ánimo en el lugar de trabajo, la seguridad del paciente y la calidad de la atención. Se ha evidenciado el aumento de errores médicos, juicios médicos e infecciones asociadas al cuidado de la salud.18 Si bien se vio que, en general, todo profesional de la salud está en riesgo de padecerlo, el personal de salud de cuidados críticos y los profesionales de cuidados paliativos están particularmente expuestos.19,20
De acuerdo con Cotella y cols., su impacto en residentes de cardiología de nuestro país se manifestó en abandono de la residencia, disminución de la calidad de atención, peor trato a los pacientes, alteraciones del sueño, aumento del riesgo cardiovascular y mayores tasas de suicidio. Asimismo, se vio que el impacto del SBO, principalmente por la despersonalización, duplica el riesgo de mala calidad de atención, conductas poco profesionales y baja satisfacción de la atención por parte del paciente.17
A su vez, Fernandez-Sánchez y cols. realizaron una evaluación en profesionales paliativistas oncológicos para valorar el efecto que el SBO puede tener en la toma de decisiones y funciones cognitivas superiores, y concluyeron que en el personal de salud con burnout existe un deterioro en estas funciones, con especial hincapié en la toma de decisiones. Altas puntuaciones en las dimensiones cansancio emocional y despersonalización se asociaron con una peor toma de decisiones.22
Cuidados paliativos cardiológicos (CPC)
Cuando un paciente crítico ingresa en la UCO, el principal objetivo es restaurar su salud con posibilidad de recuperación total o parcial mediante técnicas y tratamientos de soporte vital. Con la disminución de la mortalidad cardiovascular global y el incremento de la esperanza de vida, se vio un aumento en las afecciones cardiovasculares crónicas, pacientes con antecedentes de múltiples intervenciones, numerosas comorbilidades y polimedicados. Esta población se encuentra en mayor riesgo de presentar descompensaciones y nuevas hospitalizaciones con atención especializada, por lo que son pacientes que obtendrán beneficio del uso sistemático de una intervención de CP (ver Figura 3).23,24
Es por esto que también debe tenerse presente la indicación de CPC en estadios específicos de la ECV, tanto crónica como aguda, teniendo en cuenta las particularidades de cada caso, las intervenciones previas y las medidas terapéuticas a instaurar, adaptándolas al estado biológico de cada paciente10,13 (ver Tabla 1).
En múltiples poblaciones se ha estudiado el efecto de la calidad de vida en el pronóstico del paciente, particularmente en pacientes con IC.25-28 Heidenreich y cols.25 evaluaron el impacto de la calidad de vida a través del cuestionario Kansas (Kansas City Cardiomyopathy Questionnaire, KCCQ), evidenciando una asociación independiente entre la calidad de vida y el pronóstico: una peor calidad de vida autopercibida por el paciente (puntaje <25) se asoció a una incidencia 5 veces mayor de hospitalización en el siguiente año y 4 veces mayor de mortalidad por todas las causas que los pacientes con una mejor calidad de vida (puntaje >75).25,26 Alla y cols. hallaron una relación entre la esfera mental de la calidad de vida (cuestionario Minnesota de calidad de vida en IC) y sobrevida y hospitalización.
A pesar de esto, se identificó que los pacientes que padecen depresión pueden tener una percepción subjetiva de su enfermedad más negativa que pacientes en misma clase funcional sin depresión, a la vez que son pacientes que pueden presentar mayor comorbilidad.28
De la misma manera, un mayor puntaje en los cuestionarios de calidad de vida implican una clase funcional más alta, por lo que no se deduce de estos estudios que incorporar medidas para mejorar la calidad de vida independientemente del tratamiento específico mejore el pronóstico de base.25 Aun teniendo esto en cuenta, se ha evidenciado con la incorporación de CP la disminución de la carga sintomática (disnea, fatiga, ansiedad y depresión) y la mejoría en la calidad de vida en estos pacientes.29,30,31
Dentro de las condiciones clínicas más frecuentes, cabe mencionar:
– Angina refractaria
No es menor la cantidad de pacientes que presentan angina refractaria, en algunos reportes informan hasta el 24% de los pacientes con cardiopatía isquémica, y presentan desde dolor diario hasta semanal. Esto representa un desafío terapéutico sustancial.
Es de especial importancia en estos pacientes la evaluación cuidadosa de posibilidad de revascularización, el manejo agresivo de los factores de riesgo cardiovascular y el tratamiento óptimo de posibles causas secundarias.6,32 La gravedad de la angina y el impacto que puede tener en cada caso no se asocian únicamente a la extensión de la afectación coronaria, ya que a su vez se vincula con factores psicosociales (estrés, neurosis, ansiedad y depresión) que pueden incluso limitar la respuesta terapéutica óptima. Por esto es fundamental incorporar la educación sanitaria como elemento clave en el tratamiento.32
En pacientes sin posibilidad de revascularización, además del tratamiento médico óptimo y fármacos de segunda línea terapéutica (nitritos sublinguales, ivabradina, trimetazidina, entre otros),14 se plantea un abordaje integral del dolor: desde terapia psicológica o psiquiátrica para valoración de la experiencia del dolor, la ansiedad y la depresión que implica el dolor crónico; la rehabilitación cardiovascular, alternativas con opioides y el aprendizaje de herramientas conductuales para favorecer alivio del dolor. 14,25,33 Tanto en el ámbito ambulatorio como en internación, es fundamental realizar un seguimiento continuo de la eficacia de la terapéutica, incorporando cuestionarios (por ejemplo, el cuestionario de angina de Seattle) y/o evaluando el dolor con la escala numérica análoga.
– Valvulopatías
Es de particular importancia la comunicación asertiva en pacientes portadores de valvulopatías, con el fin de explicar las expectativas y posibles resultados de cada intervención. El desarrollo de intervenciones como el implante percutáneo valvular aórtico (TAVI) y la reparación valvular mitral transcatéter (RVMT) permite ampliar el rango de pacientes candidatos a intervenciones (mayor edad, fragilidad, estadio más avanzado de la enfermedad y comorbilidades) respecto de la cirugía valvular; otras intervenciones a considerar son la valvuloplastia con balón y la comisurotomía mitral percutánea.14
En una encuesta en pacientes mayores a 75 años en plan de reemplazo valvular aórtico transcutáneo (TAVI), sólo el 7% refirió deseo de una terapéutica que prolongue su vida. El 93% manifestó deseo de alivio sintomático, posibilidades de realizar actividades específicas o mantener su independencia.14 En pacientes con estadio avanzado de IC con
6 Anemia, hipertiroidismo, hipoxemia, taquiarritmias, estrés (que engloba ansiedad y/o depresión).
enfermedad valvular mitral en quienes se implementó el RVMT, se evidenció una disminución en internaciones por IC y una franca mejoría sintomática.34
- Arritmias ventriculares
- Cardiodesfibriladores implantables (CDI) y terapia de resincronización
Existen datos sobre descargas de CDI en aproximadamente el 20% de los pacientes que se encuentran en estadios avanzados e irreversibles de la enfermedad e incluso en situación de fin de vida, lo que aporta únicamente disconfort y sufrimiento. Es por ello que existe la posibilidad de desactivación o retiro del dispositivo.10,13,16 Esta conducta se deberá llevar a cabo en conjunto con el equipo de Electrofisiología, previo diálogo y consenso con el paciente y su entorno. El consenso sobre CDI de la Sociedad Argentina de Cardiología (SAC) expresa las diferencias clave entre esta medida paliativa (la intención del médico de aceptar la decisión del paciente y la enfermedad de base como causa de muerte) y la eutanasia o suicidio asistido.35
Se ha valorado asimismo la aplicación de terapia de resincronización cardíaca (TRC) en pacientes con indicación clásica e IC en clase funcional III-IV, observándose una mejoría sustancial a nivel sintomático, que llegó a mejorar hasta un punto la clase funcional de base y la calidad de vida.13,36 A pesar de esto, se debe sopesar el riesgo de la colocación de un catéter a través del seno venoso y la consideración de que algunos pacientes podrían no responder clínicamente a pesar de la TRC. Además, hay alrededor de un 30% de pacientes que no logran clínicamente la resincronización ventricular.36
Apelando al principio de autonomía, siempre que el paciente se encuentre en pleno uso de sus facultades mentales, puede negarse a recibir tratamiento que prolongue su sobrevida. Al ser una directiva anticipada, el paciente podrá dejar asentado su deseo de no continuar con esta terapéutica. Se recomienda que el médico a cargo realice una orden escrita, dejando constancia de la aptitud del paciente para tomar decisiones.35
- Ablación
Aún luego del implante del CDI y con terapia médica óptima, los pacientes portadores de IC avanzada pueden presentar arritmias ventriculares, lo que genera descargas persistentes del dispositivo y un aumento en el riesgo de muerte súbita. Es posible reducir la carga arrítmica de los pacientes mediante ablación por radiofrecuencia percutánea, especialmente en la taquicardia ventricular (TV). No obstante, el aumento de la carga arrítmica puede representar un indicador de progresión de la patología de base, aumentando el riesgo de hospitalización por IC, muerte súbita y presentando una mortalidad de casi 50% al año. Esta evolución no se ve modificada por la ablación.13
Enfoques
Como fue mencionado previamente, existen dos perspectivas diferentes de acuerdo con el tiempo de evolución:4
Por un lado, dentro de las patologías crónicas, el paradigma clásico es la indicación de CP en estadios avanzados de la IC7, siendo recomendación 1.16,37,38 A pesar de ello, las guías toman elementos de los CP primarios y su inclusión temprana en el seguimiento de estos pacientes,16 en quienes se ha demostrado una mejoría significativa asociada al alivio de la ansiedad y depresión, el abordaje de directivas anticipadas, y la relación entre la unidad paciente-familia y el equipo médico. Esto último es aplicable también a la angina refractaria crónica, valvulopatías, hipertensión arterial pulmonar, enfermedad arterial periférica, entre otras.14 En estos pacientes, existen momentos clave en los que tener en cuenta la incorporación de CP: la recurrencia de episodios de descompensación en un lapso de seis meses a pesar de una terapia óptima, la aparición de arritmias malignas, la necesidad de terapias intravenosas frecuentes o continuas, una baja calidad de vida crónica, síntomas en clase funcional IV difíciles de tratar y signos de caquexia cardíaca (ver Figura 5).10 Por el otro, se plantea la necesidad de una estrategia de CP primarios en pacientes con patologías agudas con elevada mortalidad. De acuerdo con datos recabados de registros nacionales entre el 2016 y el 2022 (ARGEN-IAM, ARGEN-IC, ARGEN-CCV, registro de tromboembolismo pulmonar de CONAREC),40-43 las patologías con mayor prevalencia y mortalidad que se reciben en las UCO del país datan aproximadamente de un 37% de mortalidad intrahospitalaria. Esta aproximación no tiene en cuenta otras patologías de elevada mortalidad como los síndromes aórticos agudos y las arritmias primarias.
Irrespectivamente, las necesidades de CP pueden y deben ser abordadas por el equipo interdisciplinario de salud del paciente (cuidados paliativos primarios), e incluyen la clarificación de sus valores fundamentales, objetivos de salud y preferencias terapéuticas.
La perspectiva desde los CP jerarquiza la toma de decisiones compartida para conseguir que los tratamientos se adecuen a los objetivos y valores del paciente en todo el espectro de la enfermedad grave.13 Los profesionales especializados en CP pueden ser consultados para brindar atención colaborativa a pacientes y sus familias con necesidades más complejas.10 La guía de IC de la American Heart Association sugiere la incorporación de CP especializados en caso de síntomas refractarios y/o multimorbilidad, elevada fragilidad y alteraciones cognitivas.16
7 Cabe resaltar que las indicaciones por guías hacen alusión a los CP especializados (o secundarios).
- Cuidados paliativos primarios: abordaje sintomático
En el consenso de 2017 de Radbruch y cols. que revisa la definición establecida por la OMS,2 se expresa la disconformidad del 53% de los paliativistas expertos participantes sobre el apartado que apela al manejo experto de los síntomas (“impeccable management of pain, physical, psychosocial and spiritual problems”) por la dificultad que representa en la práctica su resolución total.7 Independientemente, queda esclarecida la necesidad de priorizar y optimizar el abordaje sintomático en los pacientes con ECV. Más allá de su experiencia displacentera, tienen en común la dificultad de su valoración y estratificación, así como el peor pronóstico y prolongación del tiempo de internación en la UCO. La valoración sintomática para indicar o estimar los CP instaurados se puede realizar a través del cuestionario de evaluación de síntomas de Edmonton (ESAS, adaptado de pacientes oncológicos, ver Figura 6).15,44 A continuación se resumen algunas consideraciones (ver Tabla 2):
Dolor
Es fundamental la evaluación sistemática tanto de su presencia como de la respuesta
terapéutica instaurada; su medida de referencia estándar es el autorreporte del paciente y la valoración puede realizarse con la escala numérica análoga (0-10). En pacientes críticos por el estado de conciencia, por síntomas acompañantes como disnea o por requerimiento de asistencia respiratoria mecánica, la incapacidad para comunicarse claramente no invalida la experiencia del dolor del paciente ni la necesidad de un manejo adecuado; en ellos la escala BPS y BPS-NI (behavioural pain scale y la misma en pacientes no intubados), así como el CPOT (Critical Care Pain Observation Tool), demuestran la mayor validez y fiabilidad para monitorear el dolor.45
La titulación cuidadosa de las opciones terapéuticas y su adaptación a cada tipo de paciente es fundamental para balancear riesgo y beneficio del uso de opioides, ya que el espectro de efectos adversos (EA) que presentan no es menor (sedación, delirio, íleo, depresión respiratoria, inmunosupresión, entre otros). Se ha demostrado que los opioides desarrollan tolerancia (mayor requerimiento del fármaco para el mismo efecto analgésico) e incluso pueden generar hiperexcitabilidad neuronal central y periférica que puede amplificar y prolongar el dolor, generando potencialmente dependencia.46 En este sentido, se recomienda el tratamiento farmacológico multimodal para optimizar la analgesia como estrategia ahorradora de opioides, utilizando blancos moleculares diferentes para cada tipo de dolor, generando sinergia y así minimizar sus efectos adversos.15
Se puede diferenciar el tratamiento en pacientes vírgenes de opioides y aquellos que ya presentan un tratamiento basal con ellos. Indistintamente, se deben tomar en cuenta los
posibles efectos adversos frecuentes, evaluar diariamente su presencia e incluso considerar la profilaxis para evitar su desarrollo (ver Tablas 3 y 4)47
Pacientes posquirúrgicos
Los aspectos del dolor posoperatorio (POP) de cirugía cardiovascular son únicos: múltiples sitios de dolor, inestabilidad hemodinámica en el POP inmediato y el aumento del tiempo de recuperación que genera su persistencia en estos pacientes.46
La mitad de ellos presenta dolor en más de un sitio: esternotomía, retracción torácica, heridas quirúrgicas en miembros inferiores, pleurítico y pericardítico; dolor posicional en cirugías de larga duración; dolor secundario a la invasión y a la movilización siendo el más importante el asociado a la tos por los tubos de drenaje pleural. El dolor del POP alcanza su pico máximo a las 48 horas de la intervención.46
Las complicaciones potenciales del regular control del dolor son secundarias al aumento del tono simpático que implica: náuseas, vómitos, taquicardia, aumento del consumo miocárdico de oxígeno con potencial injuria miocárdica, mayor predisposición a arritmias; limitación en toser y respirar por el dolor pleural asociado a los tubos, vinculado a atelectasia y a una mayor incidencia de infecciones respiratorias; insomnio y delirio. Todos estos elementos favorecen el retraso en la recuperación del POP y una internación más prolongada.
Disnea
Se define como “una experiencia subjetiva de malestar al respirar, que consiste en sensaciones cualitativamente distintas que varían en intensidad”, que se encuentra determinada por múltiples factores fisiológicos, psicológicos, sociales y ambientales.48
Se caracteriza por una compleja fisiopatología, debido a su naturaleza subjetiva y a que no existe correlación entre el síntoma y las variables clínicas del paciente, a la vez que se encuentra condicionada por otros factores (sociales, espirituales), por lo que su evaluación puede ser un desafío. De igual manera que el dolor, el autorreporte del paciente es la medida de referencia estándar y se puede valorar con la escala numérica análoga (0-10).49
Es uno de los síntomas más frecuentes en pacientes con IC. El manejo del síntoma, descartado causas secundarias previamente, se puede dividir en medidas generales, farmacológicas y oxigenoterapia.49
Las medidas generales son mejorar la posición del paciente, ejercicios de respiración, evitar el estrés emocional y facilitar un entorno tranquilo. La oxigenoterapia demostró efectividad en reducir la disnea principalmente en pacientes con hipoxemia. Dentro de las medidas farmacológicas, dosis bajas de opioides han demostrado un beneficio en estos pacientes, con mejoría también en la taquipnea. En pacientes ambulatorios, se puede
iniciar dosis de morfina vía oral y se titula por la noche en caso de requerirlo. Se debe prestar especial atención al perfil de EA gastrointestinales de estos, especialmente en pacientes añosos con deterioro de la función renal (ver Tabla 3).50 A su vez pueden utilizarse como segunda línea terapéutica ansiolíticos (benzodiacepinas), si bien no han demostrado un cambio significativo y su perfil de EA en pacientes añosos y con otras comorbilidades (EPOC) es problemático. En caso de pacientes con disnea refractaria, se puede considerar la sedación leve.49
Delirio
El delirio es un trastorno agudo de la atención y la conciencia, caracterizado por
cambios en la cognición y la percepción, que puede ser causado por múltiples factores, incluidos los problemas orgánicos agudos, la medicación y el entorno hospitalario. Se puede evaluar a través de herramientas validadas como el CAM-ICU (Confusion Assessment Method for the Intensive Care Unit). Su tratamiento requiere un enfoque integral que combine estrategias no farmacológicas con un uso prudente de la medicación, teniendo en cuenta el estado clínico y las necesidades individuales de cada paciente.15
Para reducir o acortar el tiempo sintomático, se pueden implementar diversas estrategias: reorientación del paciente, la estimulación cognitiva, el uso de relojes para ayudar a mantener la orientación temporal, la mejora del sueño mediante la minimización de la luz y el ruido, la reducción de la sedación para promover la vigilancia, la movilización temprana y la rehabilitación para reducir la inmovilidad y la facilitación del uso de dispositivos como audífonos o anteojos para reducir la pérdida de audición y visión.
En cuanto al tratamiento farmacológico, es importante tener en cuenta que la evidencia sobre la eficacia de los medicamentos es limitada en este contexto. La dexmedetomidina representa una buena opción terapéutica, limitada por sus EA cardiológicos.15 Aunque el haloperidol y los antipsicóticos atípicos, como la quetiapina o la risperidona, pueden ser útiles en situaciones de excitación psicomotriz o cuando hay riesgo para el paciente o terceros, no se recomienda su uso sistemático para el tratamiento del delirio en cuidados paliativos en cardiología. Sin embargo, pueden ser considerados en casos de sintomatología grave, como alucinaciones o agitación, que no responden a otras intervenciones no farmacológicas; en estas situaciones es fundamental la interconsulta psiquiátrica.15
Insomnio
El insomnio de conciliación se refiere a la dificultad para conciliar el sueño al inicio de la noche, mientras que el insomnio de mantenimiento implica dificultad para mantener el sueño durante la noche, con despertares frecuentes o tempranos. En pacientes internados
en la unidad cerrada, es común confundir el insomnio con la disrupción del sueño debido al entorno hospitalario, el ruido y la actividad constante; esto conlleva un impacto negativo significativo en la calidad de vida y el bienestar del paciente, además de aumentar el riesgo de delirio, ansiedad y depresión.15
Para prevenir este estado, se recomienda proporcionar un entorno tranquilo y propicio para dormir, con niveles mínimos de ruido y luz durante la noche. Además, se pueden implementar estrategias de higiene del sueño, como establecer una rutina regular para acostarse y levantarse.
En casos de insomnio persistente, se pueden considerar intervenciones farmacológicas, como el uso de medicamentos hipnóticos de corta duración como los fármacos de la familia Z (zolpidem), que presenta mejor respuesta en insomnio de conciliación. Se pueden considerar las benzodiacepinas a bajas dosis en el insomnio de mantenimiento, teniendo en cuenta riesgos y beneficios.15
Ansiedad y depresión
Es conocida la asociación entre la dificultad del manejo sintomático en pacientes que presentan ansiedad y depresión, y esta última vinculada fundamentalmente con una mayor tasa de hospitalización y muerte en la IC. Hasta el 20% de los pacientes con IC presentan depresión. Se pueden usar cuestionarios validados como el inventario de depresión de Beck (IDB-II) y la escala de depresión cardíaca.37 Las benzodiacepinas en bajas dosis presentan efecto ansiolítico, deben tenerse presente las posibles interacciones según comorbilidades, y como se mencionó previamente son delirogenas y se vinculan a mayor tiempo de internación cuando se dan de manera endovenosa. Existen medidas cognitivo-conductuales para el abordaje de la ansiedad y la depresión, que demostraron mejoría en el largo plazo (4 a 9 meses), no así en el corto-mediano plazo.29 En cuanto a la depresión, es importante descartar otras posibles causas orgánicas (por ej., hipotiroidismo) y solicitar precozmente la valoración por parte de un especialista en psiquiatría para su adecuado estudio y valorar las alternativas terapéuticas, ya que habitualmente los fármacos utilizados para tratarla pueden ser perjudiciales para pacientes con ECV. Tanto sertralina como escitalopram demostraron ser seguros,37 aunque en el estudio SADHART-CHF la sertralina no fue superior a placebo en pacientes con IC.38 Se desrecomienda el uso de antidepresivos tricíclicos para su tratamiento por el perfil de EA cardiológicos.
Se puede presentar, en pacientes terminales, un cuadro de ansiedad por muerte (“death anxiety”), que agrava su depresión. Si bien las intervenciones psicosociales no han demostrado mejoría en el pronóstico, alivian significativamente los síntomas depresivos,37 por lo que es una terapia a considerar a los fines de la perspectiva de CP.
Sedación
La sedación en pacientes que requieran asistencia respiratoria mecánica, por un procedimiento, por dolor o disnea refractarios al tratamiento, se recomienda como una medida para mejorar el confort del paciente. Se sugiere una sedación leve, preferentemente con un puntaje RASS entre -2 y +1, y evitar el uso de benzodiacepinas debido a que se han asociado a mayor tiempo de intubación, necesidad de traqueostomía y duración de la hospitalización comparativamente con propofol o dexmedetomidina. Se deben tener en cuenta los EA cardiológicos de estos medicamentos (que son limitantes), como la hipotensión y la bradicardia.15
Como otros elementos a tener en cuenta, la dexmedetomidina se ha asociado con una menor tasa de delirio en comparación con otras opciones de sedación. A su vez, el propofol se vio asociado a mayor riesgo de autoextubación. A pesar de esto, por lo previamente mencionado, parecen ser una mejor opción terapéutica que las benzodiacepinas.
Discusión
Las barreras de acceso a los cuidados paliativos en la cardiología y la UCO son multifacéticas y pueden entenderse como estructurales (gestión gubernamental), del equipo de salud o del paciente y su entorno.
De acuerdo con lo recabado epidemiológicamente, si bien nuestro país cuenta con los recursos materiales para la implementación de CP en el ámbito intrahospitalario, queda expuesto que aún hay un largo camino por recorrer en materia legislativa. Esto implica un obstáculo colosal en dirección al desarrollo científico en el tema, su inclusión en los programas formativos de instituciones de todo el espectro de profesiones de la salud y su implementación rigurosa en el ámbito intrahospitalario en el servicio de cardiología, con especial atención en las unidades cerradas. A pesar de ello y según lo expuesto, es menester el compromiso del sistema de salud y de las sociedades científicas de atender y dar entidad a la falta de una definición unificada del concepto de los CP y en particular de los CPC, siendo la barrera conceptual más importante.
Para superar estas barreras, es crucial mejorar la formación y sensibilización del personal médico sobre los CP y su importancia en el manejo integral de los pacientes con ECV en situaciones críticas, así como promover una comunicación más abierta y efectiva con los pacientes y sus familias sobre los beneficios de los CP. Esto puede colaborar a la hora de superar los obstáculos que se presentan por parte del paciente y su entorno para su implementación.
Es necesario modificar el paradigma y los conceptos sobre los CP en el contexto cardiológico, reconociendo que la indicación precoz de los cuidados paliativos no solo busca aliviar el sufrimiento del paciente crítico, sino que también puede mejorar su pronóstico al abordar y manejar de manera efectiva sus comorbilidades y necesidades biopsicosociales, disminuyendo así el tiempo de internación y el desarrollo de complicaciones asociadas a esta.
Existe una creciente evidencia que sugiere que el abordaje de los CP puede tener repercusiones orgánicas positivas en pacientes con enfermedades cardiovasculares. Por ejemplo, tratar el dolor de manera adecuada puede ayudar a reducir la incidencia de fibrilación auricular y otras arritmias en pacientes posquirúrgicos, mientras que el tratamiento de la depresión puede estar asociado con una reducción en las hospitalizaciones por insuficiencia cardíaca y una mejor calidad de vida en pacientes con enfermedad cardíaca crónica.
A pesar de los beneficios potenciales, existen limitaciones en la incorporación de ciertos elementos de CP en esta población. Ciertas intervenciones implican un costo significativo en nuestro entorno que quizás no sea practicable, por tomar como ejemplo la indicación de TAVI para tratamiento paliativo, ya que actualmente se indica en pacientes con esperanza de vida mayor a 1 año.
Interesa destacar que en la extensa definición de la OMS de CP, se explicita: “siempre que sea posible, estas intervenciones deben estar basadas en la evidencia”. De esto se deduce que existe una responsabilidad científico-médica a la hora de incorporar estrategias que mejoren la sintomatología de los pacientes, pero que no excluye medidas que no tengan significancia estadística, siempre que sean seguras.
De la misma manera en la que se toman conductas en pacientes para el sostén hemodinámico y mejoría sintomática quizás sin una gran recopilación de evidencia en cuanto a mortalidad cardiovascular o eventos cardiovasculares (por ej., catéter de Swan Ganz, diuréticos endovenosos, inotrópicos), podemos pensar a los CPC como una intervención no sólo posible sino necesaria en pacientes críticos de la UCO. Si, por ejemplo, el abordaje de la depresión disminuye no solo la carga sintomática de un paciente internado sino que disminuye el tiempo de internación a la vez que favorece la adherencia terapéutica, debemos contar con las herramientas para poder abordarla de la manera más adecuada. Si bien aún falta estudio al respecto, sería esperable que un paciente compensado desde el punto de vista psiquiátrico o sintomático (por ej., dolor) presente menos internaciones, ya que se conoce su implicancia en la descompensación de la IC.
Para lograr la integración de CP en Cardiología, se deben tomar medidas concretas para hacer propios los desafíos que esto implica: el trabajo interdisciplinario y la formación del equipo de salud cardiovascular como actores principales de los CP primarios en el entorno hospitalario, y como profesionales a cargo del seguimiento transversal del paciente con riesgo de vida. La formación no solamente en la detección de los síntomas satelitales a las patologías de base, sino en su tratamiento precoz, la inclusión de CP secundarios de manera oportuna y fundamentalmente la educación en la comunicación hacia la unidad terapéutica paciente-familia para el manejo de directivas anticipadas y clarificación de los objetivos terapéuticos en relación con el pronóstico del paciente y sus deseos en torno a su calidad de vida y calidad de muerte.
Se han propuesto múltiples alternativas para la prevención y el abordaje del SBO; la mayoría son relegadas de manera individual a cada profesional de la salud (mindfulness, tomarse vacaciones, realizar actividad física o actividades extracurriculares). Si bien se
evidenció una mejoría significativa con su implementación, se requieren medidas institucionales de mayor impacto para reducir el riesgo de burnout: reducción de carga horaria laboral, espacios de formación y contención de profesionales que tratan con situaciones de fin de vida, favorecer los espacios de comunicación entre el equipo de salud entre sí, y para con el paciente y su entorno. Se pueden implementar programas de apoyo y asesoramiento para el personal médico en riesgo de burnout, para lo cual es necesario su cribado y la valoración de la magnitud y el impacto que presenta en la actualidad.
Estos elementos parecen ser determinantes clave de las barreras al acceso de CP en nuestro medio. La integración de estos componentes puede estimular la sensibilidad del personal de salud que ha sido relegada durante años en el proceso formativo con la idea de optimizar la atención al paciente, con un costo altísimo en la perspectiva humanitaria de la medicina, con la consecuente dificultad de tratar la muerte y el proceso alrededor de esta por la propia idea de finitud.
Conclusiones
Los cuidados paliativos primarios deben iniciarse en la fase temprana de la enfermedad en lugar de considerarse únicamente para pacientes en condiciones irreversibles de enfermedad o terminales. Estos brindan herramientas contundentes para mejorar la calidad de vida del paciente y la relación médico-paciente. Dentro de ellas, se encuentran el reconocimiento precoz de pacientes que se vean beneficiados de CP primarios, la comunicación asertiva para definir en conjunto los objetivos de los tratamientos a instaurar y sus expectativas realistas, y los tratamientos médicos y farmacológicos para el control sintomático.
Si bien falta información, la evidencia disponible respalda la incorporación de CP en pacientes con enfermedades cardiovasculares. Es destacable que los pacientes con un manejo sintomático adecuado presentan menor tiempo de rehabilitación de su patología de base, menor tiempo con asistencia respiratoria mecánica y de internación.
Es un pilar fundamental la formación del personal de salud en este tema. Representa un límite constitutivo la falta de definición en materia legislativa y con esto su gestión para incorporar medidas educativas y estructurales de CP a nivel nacional.
Falta estudiar aún la cuantía y qué implicancias presenta el grado de burnout del personal de salud en nuestro país y en Cardiología en particular. Asimismo, faltan datos unificados sobre mortalidad global y por patología en las UCO del país, de cara a reconocer estos datos y promover la incorporación temprana de CP y medidas de apoyo al personal de salud.
En definitiva, los objetivos históricos de la medicina se centran en una persona que padece una condición limitante en su vida para intentar aliviarla y, en el mejor de los casos, resolverla. En ese intento, el acompañamiento del paciente en su enfermedad, el padecimiento y el proceso de muerte es el componente fundacional en nuestra práctica cotidiana.
Referencias
- Arrarte, J. A. P. (2017). De las unidades de cuidado coronario a las unidades de cuidado intensivo cardiovascular: una evolución inevitable. Revista Uruguaya de Cardiología, 32(3), 229-233.
- González-Juanatey, J. R., Bermejo, R. A., & López-Sendón, J. (2017). Una historia resumida. Impacto de los avances en cardiopatía isquémica. Revista Española de Cardiología Suplementos, 17, 2-6.
- Takaoka, Y., Hamatani, Y., Shibata, T., Oishi, S., Utsunomiya, A., Kawai, F., Komiyama, N. & Mizuno, A. (2022). Quality indicators of palliative care for cardiovascular intensive care. Journal of Intensive Care, 10(1), 15.
- Ecarnot, F., Meunier-Beillard, N., Seronde, M. F., Chopard, R., Schiele, F., Quenot, J. P., & Meneveau, N. (2018). End-of-life situations in cardiology: a qualitative study of physicians’ and nurses’ experience in a large university hospital. BMC Palliative Care, 17(1), 1-11.
- Pastrana, T., De Lima, L., Sánchez-Cárdenas, M., Van Steijn, D., Garralda, E., Pons, J.J., Centeno, C. (2021). Atlas de Cuidados Paliativos en Latinoamérica 2020 (2ª ed.).
- Boletín oficial LEY DE CUIDADOS PALIATIVOS N° 26.678 y su correspondiente anexo (ANEXO – REGLAMENTACIÓN DE LA LEY N° 27.678 “CUIDADOS PALIATIVOS”). 21 de
julio de 2022.
- Radbruch, L., De Lima, L., Knaul, F., Wenk, R., Ali, Z., Bhatnaghar, S., … & Pastrana, T. (2020). Redefining palliative care—a new consensus-based definition. Journal of Pain and Symptom Management, 60(4), 754-764.
- Organización Mundial de la Salud. Informe sobre la salud en el mundo 2002: reduciendo riesgos, promoviendo una vida saludable. Ginebra: Organización Mundial de la Salud; 2002.
- Knaul, F., Radbruch, L., Connor, S., de Lima, L., Arreola-Ornelas, H., & Mendez Carniado,
O. (2020). How many adults and children are in need of palliative care worldwide. Global Atlas of Palliative Care 2nd edition [Internet]. London: Worldwide Hospice and Palliative Care Alliance (WHPCA) and the World Health Organization (WHO).
- Jaarsma, T., Beattie, J. M., Ryder, M., Rutten, F. H., McDonagh, T., Mohacsi, P., … & McMurray, J. (2009). Palliative care in heart failure: a position statement from the palliative care workshop of the Heart Failure Association of the European Society of Cardiology. European Journal of Heart Failure, 11(5), 433-443.
- Pezzano, L. (2006). Directivas anticipadas. Una expresión de planificación anticipada del cuidado médico. Revista del Hospital Italiano de Buenos Aires, 26(4).
- Ministerio de Salud, Argentina. Boletín de enfermedades no transmisibles, 2021.
- Slavin, S. D., & Warraich, H. J. (2020). El momento óptimo para comenzar los cuidados paliativos en insuficiencia cardiaca: una revisión narrativa. Revista Española de Cardiología, 73(1), 78-83.
- Godfrey, S., Kirkpatrick, J. N., Kramer, D. B., & Sulistio, M. S. (2023). Expanding the Paradigm for Cardiovascular Palliative Care. Circulation, 148(13), 1039-1052.
- Devlin, J. W., Skrobik, Y., Gélinas, C., Needham, D. M., Slooter, A. J., Pandharipande, P. P., … & Alhazzani, W. (2018). Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Critical Care Medicine, 46(9), e825-e873.
- Drazner, M. H., Dunlay, S. M., Evers, L. R., Fang, J. C., Fedson, S. E., Fonarow, G. C., … & Nnacheta, L. C. (2022). 2022 AHA/ACC/HFSA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation, (145), e895-e1032.
- Cotella, J. I., & Beder, G. F. (2020). Síndrome de Burnout en residentes de cardiología. Revista de la Federación Argentina de Cardiología, 49(4), 143-146.
- Dzau, V. J., Kirch, D. G., & Nasca, T. J. (2018). To care is human—collectively confronting the clinician-burnout crisis. N Engl J Med, 378(4), 312-314.
- Oddi, A. A., Costa, Y. C., D’Imperio, H., Prieto, O., Gantesti, J., López, C., … & Delfino, F. (2023). Encuesta burnout (¿estás quemado?) en Especialistas de Cardiología SAC: pp. 413-421. Revista Argentina de Cardiología.
- Kleinpell, R., Moss, M., Good, V. S., Gozal, D., & Sessler, C. N. (2020). The critical nature of addressing burnout prevention: results from the critical care societies collaborative’s national summit and survey on prevention and management of burnout in the ICU. Critical Care Medicine, 48(2), 249-253.
- Aguilar, C. A., & Huertas, L. A. (2015). Burnout y afrontamiento en los profesionales de salud en una unidad de cuidados paliativos oncológicos. Psicología y Salud, 25(1), 73-81.
- Fernández-Sánchez, J. C., Pérez-Mármol, J. M., Santos-Ruiz, A. M., Pérez-García, M., & Peralta-Ramírez, M. I. (2018, August). Burnout y funciones ejecutivas en personal sanitario de Cuidados Paliativos: influencia del desgaste profesional sobre la toma de decisiones. In Anales del Sistema Sanitario de Navarra, 41(2), 171-180.
- Diez, V. B. H., Elía, L. T., Elía, M. T., Alloza, M. V., Gorris, M. D. P. S., & Rosa, J. S. (2021). Cuidados paliativos al final de la vida en la unidad de cuidados intensivos. Revista Sanitaria de Investigación, 2(12), 164.
- Swetz, K. M., & Mansel, J. K. (2020). Ethical issues and palliative care in the cardiovascular intensive care unit. The Ethical Challenges of Emerging Medical Technologies, 381-392.
- Heidenreich, P. A., Spertus, J. A., Jones, P. G., Weintraub, W. S., Rumsfeld, J. S., Rathore, S. S., … & Cardiovascular Outcomes Research Consortium. (2006). Health status identifies heart failure outpatients at risk for hospitalization or death. Journal of the American College of Cardiology, 47(4), 752-756.
- Soto, G. E., Jones, P., Weintraub, W. S., Krumholz, H. M., & Spertus, J. A. (2004). Prognostic value of health status in patients with heart failure after acute myocardial infarction. Circulation, 110(5), 546-551.
- Pokharel, Y., Khariton, Y., Tang, Y., Nassif, M. E., Chan, P. S., Arnold, S. V., … & Spertus,
J. A. (2017). Association of serial Kansas City Cardiomyopathy Questionnaire assessments with death and hospitalization in patients with heart failure with preserved and reduced ejection fraction: a secondary analysis of 2 randomized clinical trials. JAMA cardiology, 2(12), 1315-1321.
- Alla, F., Briançon, S., Guillemin, F., Juillière, Y., Mertès, P. M., Villemot, J. P., … & EPICAL Investigators. (2002). Self‐rating of quality of life provides additional prognostic information in heart failure. Insights into the EPICAL study. European journal of heart failure, 4(3), 337-343.
- Balata, M., Gbreel, M. I., Elrashedy, A. A., Westenfeld, R., Pfister, R., Zimmer, S., … & Sugiura, A. (2023). Clinical effects of cognitive behavioral therapy in heart failure patients: a meta-analysis of randomized controlled trials. BMC Complementary Medicine and Therapies, 23(1), 280.
- Sidebottom, A. C., Jorgenson, A., Richards, H., Kirven, J., & Sillah, A. (2015). Inpatient palliative care for patients with acute heart failure: outcomes from a randomized trial. Journal of palliative medicine, 18(2), 134-142.
- Rogers, J. G., Patel, C. B., Mentz, R. J., Granger, B. B., Steinhauser, K. E., Fiuzat, M., … & Tulsky, J. A. (2017). Palliative care in heart failure: the PAL-HF randomized, controlled clinical trial. Journal of the American College of Cardiology, 70(3), 331-341.
- Cohen, M. G., Pascual, M., Scirica, B. M., & Ohman, E. M. (2010). Metas terapéuticas en pacientes con angina refractaria crónica. Revista Española de Cardiología, 63(5), 571-582.
- Knuuti, J., Wijns, W., Saraste, A., Capodanno, D., Barbato, E., Funck-Brentano, C., … & Bax, J. J. (2020). Guía ESC 2019 sobre el diagnóstico y tratamiento de los síndromes coronarios crónicos. Revista Española de Cardiología, 73(6), 495-495.
- Stone, G. W., Lindenfeld, J., Abraham, W. T., Kar, S., Lim, D. S., Mishell, J. M., … & Mack, M. J. (2018). Transcatheter mitral-valve repair in patients with heart failure. New England Journal of Medicine, 379(24), 2307-2318.
- Retik, E., Eidelman, G., López Diez, J. C., Acunzo, R., Aguinaga, L., & Cáceres Monié,
C. (2021). Consenso de Cardiodesfibriladores. Sociedad Argentina de Cardiología. Rev Argentina Cardiol, 89, 1-46.
- de Cardiología, S. A. (2009). Consenso de Marcapasos y Resincronizadores. Rev Argent Cardiol, 77(4).
- McDonagh, T. A., Metra, M., Adamo, M., Gardner, R. S., Baumbach, A., Böhm, M., … & Kathrine Skibelund, A. (2021). 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal, 42(36), 3599-3726.
- Tsutsui, H., Isobe, M., Ito, H., Okumura, K., Ono, M., Kitakaze, M., … & Yamashina, A. (2019). JCS 2017/JHFS 2017 guideline on diagnosis and treatment of acute and chronic heart failure―digest version―. Circulation Journal, 83(10), 2084-2184.
- O’Connor, C. M., Jiang, W., Kuchibhatla, M., Silva, S. G., Cuffe, M. S., Callwood, D. D., … & SADHART-CHF Investigators. (2010). Safety and efficacy of sertraline for depression in patients with heart failure: results of the SADHART-CHF (Sertraline Against Depression and Heart Disease in Chronic Heart Failure) trial. Journal of the American College of Cardiology, 56(9), 692-699.
- Charask, A., Gagliardi, J., Tajer, C., Castillo Costa, Y., D’Imperio, H., Marturano, P., … & MAURO, V. (2021). Mortalidad por infarto agudo de miocardio en el registro continuo ARGEN-IAM-ST. Su relación con las diferentes terapias de reperfusión. Revista Argentina de Cardiología, 89(4), 323-331.
- Cigalini, I. M., Igolnikof, D. B., Scatularo, C. E., Jauregui, J. C., Bernal, M. I., ABOY, J. M.,
… & ZAIDEL, E. J. (2019). Tromboembolismo pulmonar agudo en la Argentina. Registro CONAREC XX. Revista Argentina de Cardiología, 87(2), 137-145.
- Lescano, A., Sorasio, G., Soricetti, J., Arakaki, D., Coronel, L., Cáceres, L., … & Fernández, A. (2020). Registro Argentino de Insuficiencia Cardíaca Aguda (ARGEN-IC). Evaluación de cohorte parcial a 30 días. Revista Argentina de Cardiología, 88(2), 118-125.
- Lescano, A. Castillo Costa, Y., David, M., Cacheda, H., Bertolotti, A…& Ferrari Ayarragaray J. ARGEN – CCV. TL. Registro ARGEN CCV: Características y evolución intrahospitalaria de la cirugía cardíaca en Argentina. Nuestros resultados parciales. https://www.sac.org.ar/wp-content/uploads/2022/12/ARGEN-CCV-TL-550.pdf
- Valcárcel, A. C., García, M. M., & Cortés, C. C. (2013). Versión española del Edmonton Symptom Assessment Sytem (ESAS): un instrumento de referencia para la valoración sintomática del paciente con cáncer avanzado. Medicina Paliativa, 20(4), 143-149.
- Goldberg MA. Evaluación del dolor en pacientes adultos críticos. AJRPT. 2024;6(1):49-51.
- Barr, L. F., Boss, M. J., Mazzeffi, M. A., Taylor, B. S., & Salenger, R. (2020). Postoperative multimodal analgesia in cardiac surgery. Critical Care Clinics, 36(4), 631-651.
- Palma, A., Taboada, P., & Nervi, F. (2010). Medicina paliativa y cuidados continuos. Ediciones UC.
- American Thoracic Society. (1999). Dyspnea. Mechanisms, assessment, and management: a consensus statement. Am J Respir Crit Care Med. 159:321–40.
- Carvajal-Valdy, G., Ferrandino-Carballo, M., & Salas-Herrera, I. (2011). Manejo paliativo de la disnea en el paciente terminal. Acta Médica Costarricense, 53(2), 79-87.
- Kida, K., Doi, S., & Suzuki, N. (2020). Palliative care in patients with advanced heart failure. Heart Failure Clinics, 16(2), 243-254.
Tablas y figuras
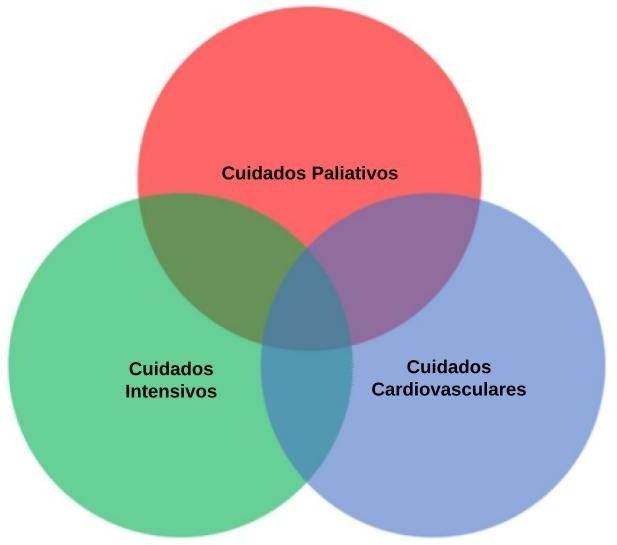
Figura 1. Solapamiento de los distintos tipos de cuidados en la UCO. Adaptado de Takaoka, Y., Hamatani, Y., Shibata, T., Oishi, S., Utsunomiya, A., Kawai, F., … & Mizuno, A. (2022). Quality indicators of palliative care for cardiovascular intensive care. Journal of Intensive Care, 10(1), 15.
Figura 2. Infografía sobre estadística en Argentina. Tomado y adaptado de Pastrana, T., De Lima, L.,Sánchez-Cárdenas, M., Van Steijn, D., Garralda, E., Pons, J. J., Centeno, C. (2021). Atlas de Cuidados Paliativos en Latinoamérica 2020 (2ª ed.).
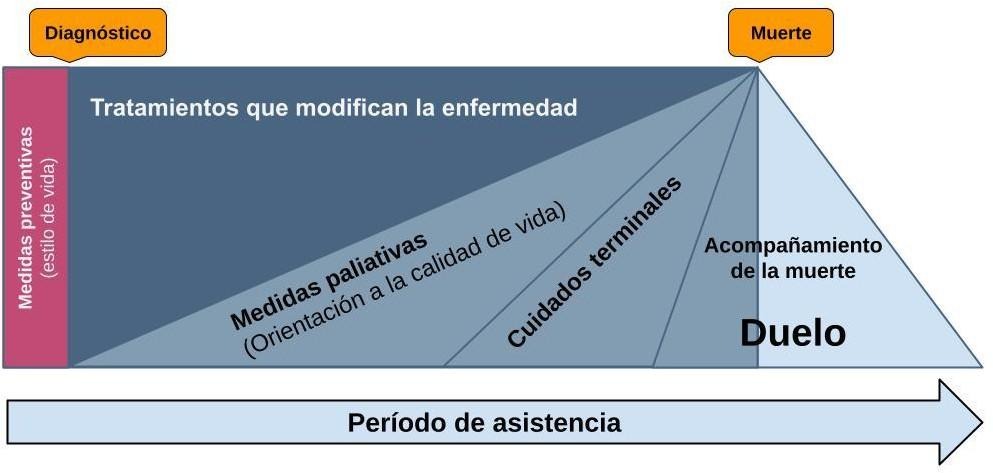
Figura 3. Modelo de incorporación de cuidados paliativos en cardiología. Tomado y adaptado de Swetz, K. M., & Mansel, J. K. (2020). Ethical issues and palliative care in the cardiovascular intensive care unit. The Ethical Challenges of Emerging Medical Technologies, 381-392.

Figura 4. Distribución porcentual de defunciones por enfermedad cardiovascular según subgrupo de causas y sexo asignado al nacer. Tomado de Ministerio de Salud, Argentina. Boletín de enfermedades no transmisibles, 2021.
Figura 5. Escala sintomática de Edmonton (traducida al español). Tomada de Valcárcel, A. C., García, M. M. y cols. (2013).
Figura 6. Evaluación del dolor, paso a paso. Tomado de Goldberg MA. Evaluación del dolor en pacientes adultos críticos. AJRPT. 2024;6(1):49-51.
Figura 7. Modelo de aplicación de cuidados paliativos cardiológicos. Tomado de Godfrey, S. (2023).
Figura 8. Algoritmo propuesto de abordaje de CP en la Unidad Coronaria. Elaboración propia.
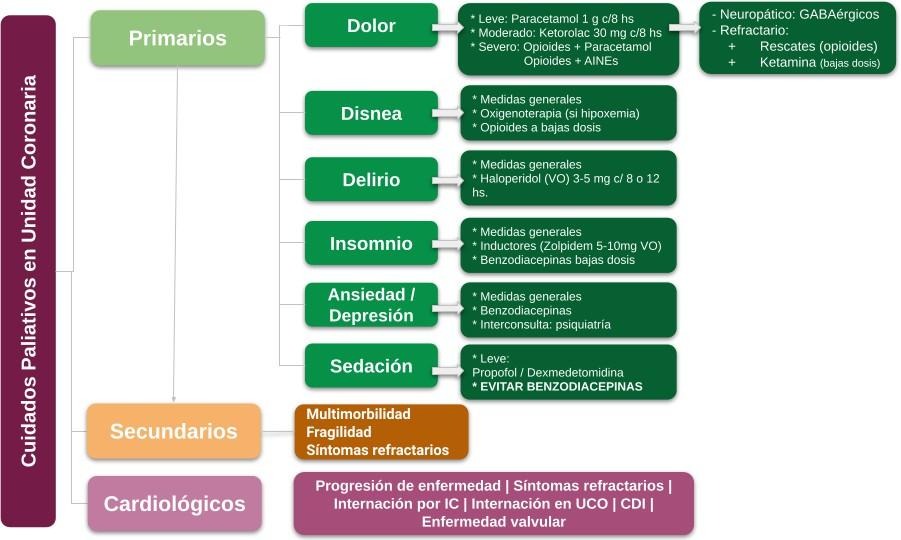
Tabla 1. Momentos críticos en la enfermedad cardiovascular que motivan la reevaluación de tratamientos cardiológicos. Adaptado de Slavin, S. D., & Warraich, H. J. y cols. (2020), de Godfrey, S., Kirkpatrick, y cols (2023).
| Episodio de asistencia | Selección de los pacientes | Posibles beneficios |
Progresión de IC (pacientes ambulatorios) | NYHA III-IV más 1 de las siguientes:Pérdida de peso ≥6% del peso corporal totalCaquexia cardíacaMala calidad de vida (escala analógica<50%)Hospitalización reciente para diuresisEsperanza de vida <1 año | Mejora en la clase NYHA/reducción de los síntomas.Mejora de la calidad de vidaReducción de las hospitalizaciones. |
Hospitalización por IC | Pacientes ingresados por IC aguda más 1 de las siguientes≥3 ingresos en 1 añoPuntuación ESCAPE* ≥4Uso crónico de fármacos inotrópicosEsperanza de vida <1 año | Mejoría sintomáticaMejora de la salud mentalMejora de la calidad de vidaMejora del bienestar espiritualReducción de los reingresos |
Ingreso en UCO | Igual que lo indicado para los pacientes hospitalizados, con especial consideración para los pacientes en shock cardiogénico debido a su alta mortalidad | Similar al anterior.Pueden ser especialmente beneficiosos por lo que implica el afrontamiento de la enfermedad, el conocimiento del pronóstico y la toma de decisiones al final de la vida. |
Implante de CDI | Considerar su posible conveniencia en todos los pacientes. | Similar a lo antes indicado, además:Mejora de la toma de decisiones respecto a la intervención.Preparación para las consideraciones específicas respecto al final de la vida. |
Intervenciones valvulares | Pacientes evaluados para TAVI o intervención en la válvula mitral si presentan:- IC en clase funcional IV-III y alguno de los criterios previamente indicados. |
* La escala ESCAPE valora el riesgo de reinternación o mortalidad a 6 meses en pacientes con internación reciente. Incluye parámetros como edad, sodio plasmático, requerimiento de IOT/ARM o paro cardíaco, tratamiento con betabloqueantes, NT-proBNP, entre otros.
Tabla 2. Características farmacológicas de las drogas utilizadas en el tratamiento sintomático.
| Clase/droga | Farmacología | Indicaciones | Comentarios |
| OpioidesMorfinaFentaniloTramadolCodeína | Agonista de receptor opiáceo (Mu).MorfinaVida media: 2 a 4 hs.Dosis:10-30 mg (VO, jarabe o comprimidos). Presenta primer paso hepático.10 mg/ml, 1 mg/ml (EV) Inicio de acción: 15-30 min (VO), 5 min (EV). Duración de analgesia: 3 – 6 hs.Metabolismo: hepático, glucuronidación. Eliminación: orina, heces. Fentanilo Agonista fuerte. Vida media: 3.7 hs Dosis: 2 mcg/kg.Infusión continua: 0.7 a 5 mcg/kg/hInicio de acción: 5 min (ev), 30-60 min (vo/SL). Duración de analgesia: 4 – 6 hs.Metabolismo: hepático vía CYP3A4. Eliminación: renal. TramadolAgonista débil.Vida media: 6 a 7 hs. Dosis máxima: 400 mg/día. CodeínaAgonista débil, vía oral exclusiva. Profármaco, activado vía CYP2D6. Vida media: 4 hs. | Dolor moderado a severo (agonistas fuertes, NO usar agonistas débiles).MorfinaDosis inicial (VO): 5 mg cada 4 hs. Si comorbilidades o edad>60 años, administrarcada 6 hs.Dosis (EV): 0.1 mg/kg; en >60 años 0.05 mg/kg.Dosis de rescate: 10% de dosis total diaria.Disnea/tos refractaria. | EA: depresión respiratoria, hipo, confusión, somnolencia. Alucinaciones. Prurito severo. Hipogonadismo. Inmunosupresión.Gastrointestinales: boca seca, náuseas, vómitos, constipación, íleo. Anorexia.Nefrourológicos: retención aguda de orina.Cardiovasculares: hipotensión, bradicardia. Angina, paro cardíaco. Prolongación de intervalo QT, aumento del segmento ST. Taquicardia ventricular. Considerar profilaxis con antieméticos y procinéticos Dolor por opioides: considerar ketamina.Prurito por opioides: antihistamínicos. Si se presenta sobredosis, antídoto:🔺 Naloxona.Administración:EV, inicio de acción 2 min. Se preparan 0.4 mg en 9 cc de solución fisiológica; con una concentración de0.04 mg/ml, se administran 2 ml y se valora respuesta. Ante persistencia de síntomas, se administra 1 ml extra cada 10 min, hasta reversión total.Considerar pacientes con toma habitual. Desarrollan tolerancia y dependencia.Tener presente en pacientes con EPOC o enfisema pulmonar el aumento de secreciones.🔺 Precaución en pacientes con IRSS.🔺 Precaución en falla renal. |
| Opioide | Factor de conversión |
| Morfina | 1 |
| Fentanilo (ev) | 100 |
| Tramadol | 0.1 |
| Codeína | 0.15 |
| Dosis máxima: 400 mg/día. | |||
| AINEKetorolacDiclofenac | Analgésicos no esteroides. Inhiben COX-1 y 2 y su ruta metabólica.KetorolacDosis:10-20 mg (vo)10 mg (SL)30 mg (ev)Inicio de acción: 5-10 min (ev), 30-60 min (vo/SL). Duración: 4 – 6 hsMetabolismo: hepático (mínimo). Eliminación: renal.Diclofenac*Considerar sal potásica en pacientes hipertensos. Dosis:25-50-75 mg (vo).50-75 mg (vo). Inicio de acción:Metabolismo: hepático (mínimo)Excreción: mayoritariamente excreción renal. | Dolor leve a moderado (diclofenac).Manejo breve de dolor moderado a severo (ketorolac). + Contraindicado en pacientes con falla renal.+ Evitar en pacientes con antecedentes de falla renal. | EA:gastrointestinales (náuseas, vómitos, dispepsia, úlcera gástrica, constipación). Cefalea. Trastornos electrolíticos. Alteración hepática. Hipertensión.Se han reportado infarto de miocardio, accidente cerebrovascular y otros fenómenos tromboembólicos (frecuencia no definida), por lo que se debe usar la menor dosis posible por el menor tiempo posible. Ketorolac: considerar disminuir dosis en pacientes>65 años, peso<50 kg y creatinina sérica aumentada. 🔺 NO ADMINISTRAR POR MÁS DE 3 DÍAS. |
| GABAérgicos | Inhibidores de receptor GABA. | – Dolor neuropático, primera | EA: somnolencia, mareos. Cefalea. Ideación suicida. |
| PregabalinaGabapentin | PregabalinaDosis inicial/dosis máxima:(ClCr, ml/min)>60: 150/600, en 2 o 3 tomas diarias.>30 a 59: 75/300 mg, en 2 o 3 tomas diarias.>15 a 29: 25/150 mg, en 1 o 2 tomas diarias.<15: 25/75, en 1 toma.GabapentinDosis:(ClCr, ml/min)>60: 900 – 3600 mg, en 3 tomas diarias.>30 a 59: 400 a 1400 mg, en dos tomas diarias.>15 a 29: 200 a 700 mg, en una toma diaria.<15: 100 a 300 mg, en una toma diaria. | línea terapéutica. | Edemas periféricos, aumento de peso. Prolongación de intervalo PR, elevación de CPK. Plaquetopenia (Pregabalina). Se deben titular en dosis creciente según tolerancia.Requieren nutrición enteral o capacidad de deglución.🔺 Evitar discontinuación abrupta.🔺 Se deben ajustar en función renal deteriorada; en pacientes dialíticos se debe dar dosis de refuerzo luego de la misma*. |
| Duloxetina | Antidepresivo inhibidor de la recaptación de serotonina (IRSS).Dosis:30 – 60 mg (vo) en una toma diaria. Dosis máxima: 60 mg/día. | – Dolor neuropático | EA: ideación suicida. Hipotensión ortostática, síncope. Hiponatremia. Se debe titular la dosis; no suspender abruptamente.No tiene evidencia de efectividad en dolor a largo plazo (>12 meses).No administrar en falla hepática.No dar en pacientes con falla renal (ClCr <30 ml/min).🔺 Aumenta el riesgo de sangrado (usar con precaución con antiagregantes plaquetarios y anticoagulantes);🔺 No administrar en conjunto con un inhibidor de monoaminooxidasa (Ketamina).🔺 No administrar en pacientes con glaucoma de ángulo cerrado. |
| Paracetamol | Antipirético. Acción analgésica moderada. | – Fiebre. | EA: mareos, desorientación. Rash. Pancitopenia. |
| Dosis:500-600-1000 mg (vo).1000 mg (ev)Dosis máxima: 4 g/día (según bibliografía), aceptado: 3 gr/día.Metabolismo: hepático. | Dolor moderado a leve.Ahorrador/modulador de opioides. | Hepatotoxicidad, falla hepática. Nefrotoxicidad. Contraindicado en falla hepática.Evitar en pacientes con alteraciones hepáticas.No presenta efecto en dolor neuropático. | |
| Dexmedetomidina | Agonista adrenérgico alfa-2Agonista débil periférico alfa-1 con infusión rápida Dosis de carga0.5–1 mcg/kg Dosis de mantenimiento0.2 – 1.4 mcg/kg/h | Sedación en pacientes intubados o no intubados.Delirio hiperactivo en pacientes durante extubación. | EA: hipotensión o hipertensión; bradicardia profunda. Inestabilidad hemodinámica. En pacientes que rotan sedación, no se requiere dosis de carga.🔺 Ajustar dosis en pacientes >65 años y en alteraciones hepáticas.🔺 Se recomienda su uso en infusión continua por no más de 24 horas. |
| Ketamina | Anestésico general no barbitúrico (antagonista NMDA. En menor medida, Mu, GABA, muscarínico y monoaminérgico).Dosis:Bolo: hasta 0.35 mg/kg (ev)Infusión: 0.1 – 0.1 mg/kg/h Metabolismo:Eliminación: | Coadyuvante analgésicoDolor secundario a opioides | EA: confusión, delirio, excitación, alucinaciones. Sialorrea. Hiper o hipotensión. Hipertensión intraocular o intracraneal.Si bien existen protocolos para su uso como analgésico con buena respuesta en pacientes críticos, por presentar efectos adversos cardiovasculares se recomienda su uso con precaución en pacientes cardiópatas.15🔺 No se recomienda su uso en pacientes con cardiopatía mal controlada. |
| Benzodiacepinas | Acción depresora a nivel del sistema nervioso central, presuntamente vía receptores GABA. | – Ansiedad asociada a depresión | EA: mareos, somnolencia. Hipomanía, manía. Amnesia. Depresión, cefalea, confusión. Suicidio. |
| LorazepamVida media: 12-18 hsDosis: 2 a 8 mg/día (vo), en 2 tomas0.05mg/kg a 4 mg (im/iv – dosis máxima)Infusión continua: 0.01 – 0.1 mg/kg/hAlprazolamVida media: 11 hsDosis: 0.25 mg (vo), 3 veces al díaDosis máxima: 4 mg/día (vo)ClonazepamVida media:Dosis: inicial 0.5 mg, en 2 tomas diarias.Dosis máxima: 4 mg/día en 2 o 3 tomas diarias.MidazolamVida media: 5 a 23 h.Dosis: 10 mg, única dosis (IM)Infusión continua: 0.02 a 0.2 mg/kg/h Metabolismo: hepático, vía CYP3A4 (alprazolam) Excreción: renal. | Trastorno de pánicoSedación profunda (no se recomienda, ver Sedación).Insomnio de mantenimiento | Depresión respiratoria. Boca seca, constipación o diarrea. Alteraciones hepáticas. Hipotensión, síncope, taquicardia, palpitaciones.Interacciones por ruta metabólica CYP3A4 (contraindicado uso conjunto con ketoconazol/itraconazol).Considerar pacientes con toma habitual; generan tolerancia y dependencia. No discontinuar de manera abrupta.En pacientes con dosis máxima, seguimiento psiquiátrico.Usar con precaución en ancianos, falla renal y en pacientes con obesidad.🔺 Contraindicado en glaucoma de ángulo agudo (lorazepam)🔺 Uso concomitante con opioides aumenta la mortalidad. | |
| Análogo de benzodiacepinas (Fármacos Z)Zolpidem | Modulador de receptor GABA. Vida media: 3 hsDosis: 5 a 10 mg.Existen comprimidos de liberación prolongada. Su absorción se retrasa con las comidas.Metabolismo: hepático vía CYP (principalmente CYP3A4 y CYP2C9).Eliminación: orina y heces. | – Insomnio de inducción y mantenimiento | EA: conductas complejas durante el sueño (sonambulismo), requieren su discontinuación. Mareos, cefalea, náuseas. Alucinaciones, mialgia. Depresión respiratoria. |
| Antipsicóticos Atípicos:QuetiapinaRisperidona | Antagonistas de múltiples receptores (D1, D2, H1, alfa 1 y 2 adrenérgicos, 5-HT1A y 5-HT2.QuetiapinaVida media: 6 hs | – Delirio hiperactivo:Haloperidol 2-5 mg cada 4a 8 hs; (NO superar 20 mg/día). | EA: mareos, fatiga, síntomas extrapiramidales. Ideación e intento suicida. Somnolencia. Dislipemias. Constipación, boca seca. Aumento de peso, disfunción eréctil, oligo/amenorrea. |
| Típicos:Haloperidol | Dosis: 25 mg/día – 150 mg (vo), en 2 o 3 tomas diarias.Dosis máxima: 800 mg en 2 tomas (dosis antipsicótica)Metabolismo: hepático vía CYP3A4 Eliminación: renal | Haloperidol 3-5 mg (vo) cada 8-12 hs. NO superar 30 mg/día.- Insomnio (off-label). Ver Delirio. | Akatisia, distonía, rigidez. Síndrome neuroléptico maligno. Parkinsonismo, discinesia tardía.Hipertensión, taquicardia. Miocarditis, prolongación del intervalo QT. |
| RisperidonaVida media: 3 a 20 hsDosis: 0.25 mg a 4 mg (vo). Metabolismo: hepático, variable. CYP2D6. Eliminación: renal. Ajustar en falla renal. | En pacientes ancianos, utilizar dosis más bajas;mayor chance de desarrollo de discinesia tardía.🔺 NO USAR HALOPERIDOL DECANOATO PARA USO EV. | ||
| HaloperidolAntagonista receptores centrales D1 y D2. Vida media: 18 hs (lactato), 3 semanas (decanoato)Dosis: 0.5 a 10 mg (vo, comprimidos)2 mg/ml (vo, gotas)5 mg/ml (lactato, IM/EV)50/100 mg/ml (decanoato, IM)Metabolismo: hepático, CYP3A4. Inhibe CYP2D6. Eliminación: orina-heces. |
| Propofol | Anestésico general, presuntamente inhibidor de canales GABAA.Inicio de acción: 40s-1min. Vida media: 1 a 3 min.Distribución tricompartimental → vida media total 40 min.Dosis inicial:0.3 mg/kg/min (por al menos 5 minutos) Dosis máxima:3 mg/kg/minMetabolismo y eliminación: principalmente renal. | Sedación leve o profundaSedación periprocedimiento. | EA: de acuerdo a dosis y velocidad de infusión. En bolo, mayor riesgo de depresión cardiorrespiratoria: hipotensión, bradicardia, bradipnea, apnea, desaturación de O2. Mioclonías. Aumento de triglicéridos. Interacción con opioides y benzodiacepinas en estos efectos. Su infusión por >10 días aumenta su acumulación en tejidos, lo que puede generar un despertar enlentecido → evaluar requerimientos diarios.🔺 Síndrome de infusión de propofol: acidosis metabólica severa, hiperkalemia, rabdomiólisis, hepatomegalia, falla renal, cambios electrocardiográficos, IC.Evitar bolos reiterados en pacientes ancianos. Evitar discontinuación abrupta en pacientes realizando pruebas de extubación. |
| Consideraciones generalesIndividualizar dosisUtilizar la mínima dosis que genere el efecto deseado, por el menor tiempo posible.En caso de que exista, considerar conductas profilácticas para desarrollo de EA. Nota: las indicaciones y dosis que se incorporan en la tabla son específicamente en las indicaciones que se enumeran. Estos fármacos se utilizan ampliamente para otras condiciones, que no se detallan en la presente tabla por exceder el tema de la presente monografía. | |||
Elaboración propia con base en Kida, K., et al (2020) y Barr, L., et al (2020).
EA: efectos adversos; EV: endovenoso; IM: intramuscular, SL: sublingual; VO: vía oral. FDA: Food and Drug Administration. Mg: miligramos, mcg: microgramos.
Comentario: no se incluye en esta tabla la hipersensibilidad como efecto adverso, por ser común a todos los fármacos.
Tabla 3. Protocolo de ajuste de morfina en pacientes con insuficiencia renal. Tomado de Kida, K., Doi, S., & Suzuki, N. (2020). Palliative care in patients with advanced heart failure. Heart Failure Clinics, 16(2), 243-254.
| TFG(ml/min) | Dosis inicial (mg/h) | Infusión basal (mg/h) | Criterios para aumentar infusión basal | Criterios para disminuir infusión basal o suspender | Dosis de bolo | Intervalo entre bolos (min) |
| 15-30 | 0.5 | 0 – 1 | 3 o más bolos en 2 horas consecutivas | RR<12RASS < -1Cualquier otro EA (considerar) | Equivalente a 1 hora de infusión basal | 30 |
| <15 | 0 – 0.5 |
Agradecimientos
Quisiera agradecer a mis amigos y familia, por la paciencia y compañía de siempre. Particularmente a mi mamá, por el seguimiento entusiasta e incansable. A Agus, por contagiarnos su forma de entender el mundo y con eso motivarme a defender mi elección del tema del presente trabajo.
A los y las médicos/as de planta, que colaboraron en mi formación y también alentaron mi elección sobre el tema.
A mis compañeros de residencia, sin quienes el camino hubiera sido monumentalmente más difícil. Particularmente a mis compañeros de año, por la incondicionalidad y por enseñarme permanentemente con humildad y cariño.
Finalmente, además de agradecerles profundamente, quiero dar reconocimiento a las personas que motivaron inicialmente la idea y desarrollo de esta monografía, atravesando y trascendiendo lo médico en lo cotidiano: Ada, Ana, Claudio, Guillermo, Ezequiel, Lucas, Matías, Nahuel, Alberto y Mabel. Seguramente los nombres sean muchos más.



