1 INTRODUCCIÓN
La fibrilación auricular (FA) y la insuficiencia cardíaca (IC) son crecientes epidemias de enfermedades cardiovasculares en todo el mundo. Las mismas a menudo coexisten y cada una afecta negativamente a la otra con respecto al tratamiento y pronóstico. En el estudio Framingham la mitad de los pacientes con IC en estudio desarrollaron FA, mientras que la insuficiencia cardíaca se produjo en más de un tercio de las personas con FA. La FA es la arritmia cardíaca más común de importancia clínica, el número estimado de individuos con FA a nivel mundial es 33,5 millones.2 Ha habido un aumento exponencial en la prevalencia de la FA y la IC correlacionada con una mayor carga de factores de riesgo cardiovasculares y mejores tasas de supervivencia en pacientes con cardiopatía estructural. La FA se asocia con resultados de pronóstico adversos en la IC y es más evidente en la disfunción ventricular izquierda leve a moderada, donde la pérdida de “patada auricular” se traduce en una peor calidad de vida y un aumento de la mortalidad. En ausencia de una cardiopatía estructural subyacente, la arritmia en si puede contribuir de manera independiente al desarrollo de la cardiomiopatía. En conjunto, estas dos condiciones conllevan a un alto riesgo tromboembólico debido a la estasis, la inflamación y la disfunción celular. La prevención del accidente cerebrovascular con anticoagulación oral sigue siendo un pilar del tratamiento. A pesar de los avances en la atención y las opciones de tratamiento disponibles, incluida la ablación con catéter, el tratamiento de la FA sigue planteando un desafío terapéutico. La terapia farmacológica para el control del ritmo sigue estando limitada por la eficacia variable, la intolerancia y las reacciones adversas. La ablación con catéter para la FA ha resultado en un cambio de paradigma. Si bien su éxito terapéutico es alto para la FA paroxística, permanece subóptimo en la FA persistente. Una mejor comprensión de la FA, así como las innovaciones en la tecnología de ablación, pueden mejorar los resultados de los pacientes en el futuro. Los casos refractarios pueden beneficiarse de la ablación de la unión atrioventricular y la estimulación biventricular.
Si bien un creciente cuerpo de datos epidemiológicos, clínicos y experimentales nos ha ayudado a comprender las interrelaciones entre la FA y la IC y a guiar el manejo clínico, todavía existen varias lagunas en el conocimiento. Esta revisión se centra en la epidemiología, fisiopatología y estrategias de manejo para pacientes con FA e IC.
2 OBJETIVOS
- Demostrar asociación entre la fibrilación auricular e insuficiencia cardiaca en el desarrollo de evento cardiovasculares.
- Evaluar si la ablación con catéter es superior a la terapia convencional para la fibrilación auricular en pacientes con insuficiencia cardíaca con fracción de eyección reducida.
- Analizar los tratamientos recomendados y posibles grupos de paciente seleccionados que se beneficiaran con la terapia ablación por catéter.
3 MATERIALES Y MÉTODOS
Para la elaboración y confección de la monografía se utilizaron las recomendaciones a cargo de los profesiones de la coordinación del curso UBA-SAC. Se ha realizado una búsqueda bibliográfica relacionada con el tema de interés en capítulos de texto de cardiología clínica, en la base de datos PubMed, Medline, Cochrane, ClinicalTrials.gov y Google, aplicando en cada caso una estrategia de búsqueda específica, utilizando como criterios los términos “Atrial fibrillation”,“catheterablation”, “heartfailure”, ensayos aleatorizados y controlados de ablación de FA en comparación con la terapia convencional en adultos con FA e insuficiencia cardiaca. Se analizaron los artículos, revisiones sistemáticas, metaanálisis y ensayos clínicos hallados y se puso especial interés en aquellos que enfatizaban en comparar tratamiento médico vs ablación en paciente con insuficiencia cardiaca, destacando los ensayos aleatorizados dejando de lado los ensayos de menor calidad en cuanto a diseño y número de pacientes. Luego de la primera revisión se evaluaron las referencias utilizadas por los artículos de interés, realizando una segunda búsqueda. Se revisaron las guías nacionales e internacionales de insuficiencia cardiaca.
4 DESARROLLO
4.1 Fisiopatología
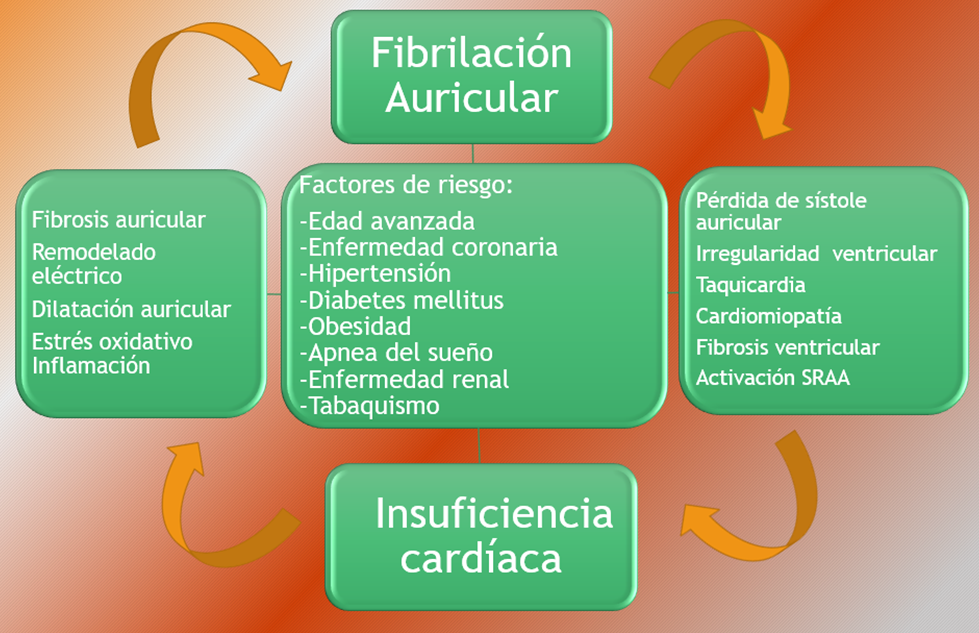
La IC y la FA comparten factores de riesgo y procesos fisiopatológicos comunes (ver Figura 1). Comorbilidades tales como hipertensión, obesidad, diabetes, insuficiencia renal, apnea del sueño, enfermedad coronaria y el tabaquismo se asocian con un mayor riesgo de desarrollar IC y FA.3 En la IC, el desequilibrio neurohormonal y la activación del sistema renina-angiotensina-aldosterona conduce a cambios fisiológicos desadaptativos, que incluyen un aumento de las presiones de llenado y la poscarga. Esto puede conducir a un aumento del estiramiento de la aurícula izquierda y la fibrosis, lo que contribuye al desarrollo de anomalías en la conducción y facilita el inicio y mantenimiento de la FA. El sistema renina-angiotensina-aldosterona también contribuye directamente a la remodelación proarrítmica, con angiotensina II causando fibrosis auricular.4 Los pacientes con IC también muestran un manejo alterado del calcio y una sobrecarga de calcio, lo que puede conducir a despolarizaciones inapropiadas y arritmia. La FA puede promover el desarrollo de IC por varios mecanismos establecidos. La pérdida de la sístole auricular en la FA afecta el llenado del ventrículo izquierdo (VI) y puede disminuir el gasto cardíaco hasta en un 25%, particularmente en pacientes con disfunción diastólica5. El gasto cardíaco disminuye en pacientes con FA debido a diversos mecanismos. El aumento de la frecuencia cardíaca en reposo y una respuesta exagerada de la frecuencia cardíaca al ejercicio da como resultado un acortamiento del tiempo de llenado diastólico, con una disminución resultante en el gasto cardíaco. La pérdida de la sincronía auriculoventricular desempeña un papel importante, al alterar el llenado diastólico, disminuir el volumen sistólico y aumentar la presión auricular diastólica media La conducción ventricular irregular y / o rápida en la FA puede conducir a disfunción del ventrículo izquierdo y, en algunos pacientes, a una miocardiopatía inducida por taquicardia. Se desconoce la incidencia de miocardiopatía inducida por taquicardia, ya que la mayoría de los informes han sido series retrospectivas pequeñas o estudios de casos que involucran principalmente a pacientes con FA. Se informó una mejoría en la fracción de eyección en pacientes que se someten a ablación por radiofrecuencia para FA o aleteo auricular, y en esta población de pacientes la incidencia de miocardiopatía inducida por taquicardia parece estar alrededor del 25-50%.6-10. La restauración del ritmo sinusal aumenta el volumen sistólico y el vaciado del VI incluso antes de que mejore la contractilidad, explicando por qué algunos pacientes con IC obtienen una mejora hemodinámica rápida con cardioversión. Hay una interacción compleja de FA y la IC. Las alteraciones en la activación neurohormonal, los parámetros electrofisiológicos y los factores mecánicos conspiran para crear un entorno en el que la IC predispone a la FA. Cada condición tiene efectos nocivos sobre la otra. El desarrollo de FA en un paciente con IC a menudo conduce a un deterioro sintomático, predispone a episodios de empeoramiento de la IC, aumenta el riesgo de episodios tromboembólicos y empeora el pronóstico a largo plazo.
4.2 Importancia pronóstica de la fibrilación auricular en la insuficiencia cardíaca
Este punto sigue siendo controversial debido a la falta de consenso de que la FA sea un factor de riesgo independiente de resultado adverso. Los ensayos más antiguos, como “Effect of vasodilator therapy on mortality in chronic congestive heart failure”(V-HeFT)11 no demostraron diferencias en la mortalidad entre pacientes con IC leve a moderada en ritmo sinusal o con el desarrollo de FA. Varios ensayos han identificado la presencia de FA como un importante predictor de mortalidad. En un análisis retrospectivo del ensayo “Effect of Enalapril on Survival in Patients with Reduced Left Ventricular Ejection Fractions and Congestive Heart Failure” (SOLVD)12 que recluto a 6517 pacientes con fracción de eyección del VI (FEVI) <35%, la FA basal fue un predictor independiente de mortalidad por todas las causas. El aumento de la mortalidad en pacientes con FA en comparación con aquellos en ritmo sinusal se debió en gran medida a un aumento en la falla de la bomba 16.3% vs. 19.5% (RR 0.78; IC 95% 0.65-0.94; P <0.0045). De manera similar, los resultados del gran ensayo aleatorizado y controlado de “Mortality and morbidity reduction with Candesartan in patients with chronic heart failure and left ventricular systolic dysfunction” (CHARM) indicaron que la FA basal en pacientes con IC sintomática confirió una mayor morbilidad y mortalidad independientemente de la fracción de eyección basal. De estos, 392 (6,08%) desarrollaron FA durante el seguimiento, 177 (5,49%) en el grupo de candesartán y 215 (6,74%) en el grupo placebo, (odds ratio 0,812, IC 95 [0,662-0,998] p = 0,048). Además, el desarrollo de FA de inicio reciente dio como resultado un mayor riesgo absoluto de eventos cardiovasculares adversos en pacientes con insuficiencia cardiaca con FEVI disminuida y un mayor riesgo relativo de muerte cardiovascular y hospitalización por IC en aquellos con función preservada del VI 13.En el ensayo clínico “Angiotensin-Converting–Enzyme Inhibitor Trandolapril in Patients with Left Ventricular Dysfunction after Myocardial Infarction” (TRACE), la mortalidad a largo plazo aumentó en todos los subgrupos de pacientes con FA, excepto en aquellos con la enfermedad más avanzada (FEVI <25%).14
El impacto de la FA en la mortalidad en pacientes con IC parece ser más evidente en pacientes con IC leve a moderada, mientras que el efecto en pacientes con IC más grave (FEVI <25%) parece ser limitado. Curiosamente, la evidencia muestra que la FA de inicio reciente tiene un peor pronóstico para los pacientes con IC que la FA crónica. Los pacientes que desarrollaron FA de inicio reciente eran mayores, en su mayoría hombres y tenían un riesgo general más alto de mortalidad cardiovascular y hospitalización por IC.
Estos ensayos sugieren que el efecto independiente de la FA en la mortalidad puede limitarse a pacientes con grados leves a moderados de IC. También se ha descubierto que el momento y la cronicidad de la FA son un factor pronóstico importante. Muchos estudios han encontrado que la FA de inicio reciente tiene un pronóstico particularmente grave en pacientes con IC.
Por último, la relación temporal entre el diagnóstico de FA y la IC tiene un impacto significativo en la mortalidad: los pacientes que desarrollaron FA después del diagnóstico de IC tuvieron un mayor riesgo de mortalidad en comparación con los pacientes en los que la FA estaba presente antes el diagnóstico de IC cocientes de riesgo de muerte no ajustados de 1.48 (IC 95%, 1.31–1.68) y 2.35 (IC 95%, 2.04–2.71), respectivamente.15
4.3 Control de frecuencia versus ritmo
Los pacientes con IC que desarrollan FA tienen una mayor morbilidad y mortalidad, lo que sugeriría que la restauración y el mantenimiento del ritmo sinusal en estos pacientes podrían mejorar sus resultados a largo plazo. A pesar de la creciente evidencia que apoya el control del ritmo y la intervención temprana para restaurar y mantener el ritmo sinusal en pacientes con FA y IC, aún existe controversia con respecto a los beneficios a largo plazo de estos enfoques. Los estudios que compararon el control de frecuencia y control de ritmo “A Comparison of Rate Control and Rhythm Control in Patients with Atrial Fibrillation” (AFFIRM)18 y “Rate Control versus Electrical Cardioversion for Persistent Atrial Fibrillation” (RACE)19 no encontraron beneficios para la estrategia de control de ritmo. El estudio AFFIRM recluto un total de 4060 pacientes (edad media [± DE], 69,7 ± 9,0 años); El 70.8 por ciento tenía antecedentes de hipertensión y el 38.2 por ciento tenía enfermedad coronaria. De los 3311 pacientes con ecocardiogramas la función ventricular izquierda estaba deprimida en un 26,0%. Hubo 356 muertes entre los pacientes asignados a la terapia de control del ritmo y 310 muertes entre los asignados a la terapia de control de la frecuencia (mortalidad a los cinco años, 23.8 por ciento y 21.3 por ciento, respectivamente; razón de riesgo, 1.15 [intervalo de confianza del 95 por ciento, 0.99 a 1.34]; P = 0.08).El estudio RACE fue un ensayo multicéntrico, prospectivo, aleatorizado que aleatorizó a 1.376 pacientes con FA e IC para recibir tratamiento de control de ritmo o control de frecuencia. El control del ritmo no redujo la mortalidad cardiovascular significativamente en comparación con el control de la frecuencia (27% frente a 25% en el control de la frecuencia; razón de riesgo en el grupo de control del ritmo, 1,06; IC del 95%: 0,86-1,30; P = 0,59), el mismo sugirió un beneficio potencial de supervivencia y una disminución de la hospitalización en pacientes con disfunción del VI que pudieron mantener el ritmo sinusal. Se postuló que los pacientes que mantenían el ritmo sinusal podrían haber sido más saludables. Además, solo el 23% de los pacientes incluidos en el ensayo tenían IC y el beneficio se compensó con una mayor mortalidad asociada con la terapia antiarrítmica, Guglin y col.20 analizaron los síntomas de la IC en los diferentes subgrupos incluidos en el estudio AFFIRM para evaluar el impacto de la frecuencia frente al control del ritmo y descubrió que el ritmo sinusal estable se asociaba con el mejor estado funcional.
Otros ensayos prospectivos aleatorizados que comparan el ritmo con el control de la frecuencia, “Rate control vs rhythm control in patients with nonvalvular persistent atrial fibrillation: the results of the Polish How to Treat Chronic Atrial Fibrillation” (HOT CAFE) 21 recluto 205 pacientes (134 hombres y 71 mujeres; edad media [+/- DE], 60.8 +/- 11.2 años) con una duración media de FA de 273.7 +/- 112.4 días. El período de observación promedio fue de 1.7 +/- 0.4 años. Al final del seguimiento, el 63,5% de los pacientes en el brazo de control del ritmo permanecieron en ritmo sinusal. No se encontraron diferencias significativas en el punto final compuesto (es decir, mortalidad por todas las causas, número de eventos tromboembólicos o hemorragia mayor) entre el grupo de control de frecuencia y el grupo de control de ritmo (odds ratio, 1.98; intervalo de confianza del 95%, 0.28 a 22,3; p> 0,71). La incidencia de ingresos hospitalarios fue mucho menor en el grupo de control de la frecuencia (12% frente a 74%, respectivamente; p <0,001). La clase funcional de la New York Heart Association mejoró en ambos grupos de estudio, mientras que la tolerancia media al ejercicio, medida por la carga de trabajo máxima en la cinta de correr, mejoró solo en el grupo de control del ritmo (5.2 +/- 5.1 vs 7.6 +/- 3.3 equivalentes metabólicos, respectivamente; p <0,001). La estrategia de control del ritmo condujo a un aumento del acortamiento fraccional del ventrículo izquierdo medio (29 +/- 7% frente a 31 +/- 7%, respectivamente; p <0.01). En el ensayo “Randomized trial of rate-control versus rhythm-control in persistent atrial fibrillation: the Strategies of Treatment of Atrial Fibrillation “ (STAF)22 que asignó al azar a 200 pacientes (100 por grupo) con FA persistente para controlar el ritmo o la frecuencia. El punto final primario combinado fue una combinación de muerte, reanimación cardiopulmonar, evento cerebrovascular y embolia sistémica, después de 19.6 +/- 8.9 meses de seguimiento (rango 0 a 36 meses) no hubo diferencia en el punto final primario entre el control del ritmo (9/100; 5.54% / año) y el control de la frecuencia (10/100; 6.09% / año ; p = 0,99). El porcentaje de pacientes en ritmo sinusal en el grupo de control de ritmo después de hasta cuatro cardioversiones durante el período de seguimiento (grupo de control de frecuencia) fue del 23% (0%) a los 36 meses. En los ensayos de intervención farmacológica “Rhythm or rate control in atrial fibrillation pharmacological Intervention in Atrial Fibrillation” (PIAF)23 mostraron resultados equivalentes en ambos brazos. Sin embargo, debe tenerse en cuenta que solo del 23% al 64% de los pacientes asignados al control del ritmo en estos estudios en realidad permanecieron en ritmo sinusal. Además, la aplicabilidad de estos datos a pacientes con insuficiencia cardíaca es cuestionable, dada la pequeña proporción de pacientes con insuficiencia cardíaca. En el ensayo AFFIRM, por ejemplo, el 76% de los pacientes tenían una FEVI normal, y solo el 9% tenía una clase funcional NYHA de II o mayor.
El ensayo “Rhythm Control versus Rate Control for Atrial Fibrillation and Heart Failure” (AF-CHF)24 fue el primer ensayo aleatorio prospectivo que extendió los hallazgos de AFFIRM a pacientes con insuficiencia cardíaca. Inscribió a 1.376 pacientes con una media de FEVI del 27% que fueron asignados al azar a grupos de control de frecuencia vs control de ritmo con amiodarona. Un seguimiento de 3 años no mostró ningún beneficio de la estrategia de control del ritmo en la insuficiencia cardíaca. Sin embargo, el 15% de los pacientes en el ensayo AF-CHF abandonaron la estrategia de tratamiento inicial a la que fueron asignados. El control del ritmo se abandonó con mayor frecuencia que el control de la frecuencia, principalmente debido a la ineficacia del tratamiento. Además, el 40% de los pacientes en el grupo de control de frecuencia estaban en ritmo sinusal durante el seguimiento. Curiosamente, el análisis de subgrupos del ensayo sugirió arritmias ventriculares además de empeorar la insuficiencia cardíaca como la razón para cambiar al control del ritmo. El control fallido de la frecuencia o el ritmo con el cruce no afectó la mortalidad cardiovascular o por todas las causas. Se ha argumentado que el beneficio de supervivencia puede haber sido atenuado por los efectos secundarios de la terapia antiarrítmica y la tasa de éxito real de la terapia con medicamentos para lograr el control del ritmo fue menor de lo previsto. Este estudio confirmó la aplicabilidad de AFFIRM y RACE. Sin embargo se requiere precaución en la interpretación y aceptación de estos datos. Primero, los pacientes asignados a la estrategia de control de la frecuencia lograron un control adecuado de la frecuencia en reposo y en ejercicio de bajo nivel, lo que puede no reflejar a los pacientes de la “vida real”. En segundo lugar, el beneficio del ritmo sinusal podría haber sido compensado por el daño de los medicamentos antiarrítmicos de manera similar al estudio AFFIRM. En tercer lugar, aunque la prevalencia del ritmo sinusal en el grupo asignado al control del ritmo fue tan alta como 80%, el porcentaje real de pacientes libres de FA después de la aleatorización puede haberse diluido debido a un cruce significativo entre los dos grupos, lo que refleja un efecto más tradicional. tasa de éxito de la amiodarona en el rango del 60%. Adicionalmente, Existe una amplia variabilidad en los mecanismos de insuficiencia cardíaca y anormalidades estructurales y hemodinámicas subyacentes. Algunos pacientes, especialmente aquellos con disfunción diastólica, son altamente sintomáticos en la FA y obtienen un beneficio significativo en la restauración del ritmo sinusal, mientras que otros pacientes no se benefician significativamente de la sincronía AV.
El control óptimo de la frecuencia ventricular en la FA es un tema de debate, las directrices recomiendan una frecuencia ventricular de 60-80 latidos por minuto en reposo y 90-110 latidos por minuto durante un esfuerzo moderado. Por lo tanto, se debe determinar un control de frecuencia adecuado con la evaluación de la respuesta cronotrópica con esfuerzo o con un monitor Holter de 24 horas. Los betabloqueantes son los agentes de primera línea para el control de la frecuencia en pacientes con FA e insuficiencia cardíaca crónica. Además de controlar la respuesta ventricular, los betabloqueantes en particular el bisoprolol, metoprolol y carvedilol han demostrado disminuir la mortalidad en la insuficiencia cardíaca25-29. Si bien los pacientes que realmente obtienen beneficios de la terapia con bloqueadores beta son aquellos que tienen insuficiencia cardíaca y ritmo sinusal, no hubo estudios convincentes para probar un beneficio derivado similar en la FA-IC hasta hace poco. En el análisis de subgrupos de pacientes con AF-CHF con IC con deterioro de la FEVI y FA, se demostró que los betabloqueantes disminuyen la mortalidad por todas las causas en un 28%, independientemente del patrón de FA. El efecto fue más pronunciado en individuos con mayor carga de FA.30
En pacientes donde no se puede lograr un control de frecuencia adecuado a pesar de los medicamentos y no se considera el control del ritmo, la ablación del nodo AV con estimulación permanente puede proporcionar un control de frecuencia efectivo. La Figura 2 proporciona una sinopsis del enfoque de tratamiento para pacientes con FA e IC basada en las directrices actuales del American CollegeofCardiology (ACC) y la EuropeanSocietyofCardiology (ESC).
4.4 Tratamiento no farmacológico de la FA en la disfunción VI
Nuestra comprensión cada vez más amplia de los mecanismos de la fibrilación auricular y las tecnologías que avanzan rápidamente han hecho de la ablación con catéter de la fibrilación auricular una modalidad cada vez más efectiva y segura de tratamiento en estos pacientes. A pesar de los estudios que sugieren un resultado equivalente para el control de ritmo farmacológico o el control de la frecuencia, muchos pacientes mejoran sintomáticamente con el mantenimiento del ritmo sinusal. El beneficio del control del ritmo puede ser contrarrestado por la falta de medicamentos antiarrítmicos efectivos, acoplados con sus importantes efectos adversos. La ablación con catéter para la FA ofrece la oportunidad única de conservar los beneficios del control del ritmo sin los efectos perjudiciales de los fármacos antiarrítmicos. En pacientes con FA e IC coexistentes, los objetivos principales del tratamiento son prevenir los resultados adversos, mejorar los síntomas y mantener una buena calidad de vida. Las directrices de la Sociedad Europea de Cardiología de 2016 sobre el manejo de la FA establecen que las “indicaciones para la ablación con catéter en pacientes con insuficiencia cardíaca con fracción de eyección reducida deben equilibrarse cuidadosamente y los procedimientos deben realizarse en centros experimentados”. Las directrices también reconocen que la ablación de FA puede ser más exigente en esta cohorte de pacientes en comparación con pacientes sin IC. En los pacientes que se presentan de forma aguda con FA e IC, las guías recomiendan centrarse en la normalización del equilibrio de líquidos, con el objetivo de alcanzar un objetivo de frecuencia cardíaca inicial de <110 lpm, el uso de anticoagulación, la inhibición del sistema renina-angiotensina-aldosterona y la consideración temprana del control del ritmo. Sin embargo, no existe un consenso claro sobre a qué pacientes con IC se les debe ofrecer la ablación con catéter o la estrategia de ablación óptima en este contexto. Se ha publicado un número creciente de estudios para evaluar la efectividad de la ablación con catéter para mejorar los resultados clínicos en pacientes con FA e IC. Estos estudios han desafiado los paradigmas de tratamiento anteriores en los que el control de la frecuencia se consideraba equivalente al control del ritmo en esta población de pacientes.
Los primeros ensayos de la ablación con catéter versus la terapia de control de frecuencia para pacientes con FA e IC incluyeron un pequeño número de pacientes y no tenían la potencia adecuada para evaluar puntos finales difíciles como la mortalidad. En el estudio “Pulmonary-Vein Isolation for Atrial Fibrillation in Patients with Heart Failure” PABA-CHF36 publicado en 2008, 81 pacientes con FA resistente a la terapia farmacológica estándar antiarrítmicos y/o betabloqueantes con una FEVI <40% fueron aleatorizados para someterse a ablación de FA con aislamiento de la vena pulmonar o ablación del nodo AV con estimulación biventricular. Los pacientes que se sometieron a aislamiento de la vena pulmonar mostraron mejoras en el punto final primario compuesto, incluida la medición de FEVI con ecocardiografía a los 6 meses la fracción de eyección fue significativamente mayor (35 ± 9% frente a 28 ± 6%, P <0.001), la distancia de caminata de 6 minutos significativamente más larga (340 ± 49 m vs. 297 ± 36 m, P <0.001), y la puntuación de calidad de vida en comparación con la ablación del nodo AV con estimulación biventricular. La mayoría de los pacientes en ambos brazos del estudio tenían miocardiopatía isquémica (73% y 68%, respectivamente) y una duración media de FA de 4 años. En el grupo de ablación, el 51% tenía FA persistente y en el grupo ablación del AV y resincronizador el 46%, donde se sabe que los resultados clínicos son inferiores a la FA paroxística, todos los pacientes sometidos a ablación del nodo AV con estimulación biventricular continuaron con FA a los 3 y 6 meses. Entre los pacientes sometidos a aislamiento de las venas pulmonares, el 78% estaban libres de FA a los 3 meses, con o sin el uso de medicamentos antiarrítmicos. A los 6 meses, se habían realizado ocho procedimientos repetidos para la fibrilación auricular recurrente (en cuatro pacientes) y el aleteo auricular o taquicardia auricular (en otros cuatro pacientes), y el 88% de los pacientes en el grupo de aislamiento de venas pulmonares no tenían fibrilación auricular con o sin el uso de medicamentos antiarrítmicos. A los 6 meses, el 71% de esos pacientes estaban libres de fibrilación auricular y de medicamentos antiarrítmicos. Todos los pacientes tuvieron recurrencia sintomática de fibrilación auricular o taquicardia auricular, excepto dos pacientes en el grupo que se sometieron a aislamiento de venas pulmonares. Curiosamente, aquellos pacientes que se sometieron a ablación del nodo AV y estimulación biventricular no mostraron mejoras más significativas en su FEVI.
En un estudio más pequeño de MacDonald y col 37. publicado en 201, que recluto treinta y ocho pacientes (edad media 63 años) con IC, FEVI <35% (media 18%) y FA persistente fueron asignados al azar a ablación por catéter de radiofrecuencia (n = 20) o una estrategia de control de frecuencia (n = 18). Se utilizó una estrategia de ablación gradual y los pacientes fueron tratados con amiodarona durante 3 meses. La FEVI se midió mediante resonancia magnética y ventriculografía con radionúclidos al inicio del estudio y 6 meses de seguimiento. El punto final primario fue el cambio en la FEVI por resonancia magnética. en estos pacientes no se encontraron diferencias en la FEVI medida con RM cardíaca en pacientes sometidos a ablación con catéter versus control de frecuencia a los 6 meses de seguimiento. En este estudio, solo se incluyeron pacientes con FA persistente, mientras que la FEVI media medida al inicio fue de solo 16,1 % en el grupo de ablación y 19.6% en el grupo médico, lo que sugiere una enfermedad más avanzada. Alrededor del 90% de los pacientes estaban en la clase III de la New York Heart Association (NYHA) o superior. Además, solo el 50% de los pacientes en el grupo de ablación mantuvo el ritmo sinusal al final del estudio. Aunque es probable que el estudio no tenga la potencia suficiente para detectar una diferencia en el punto final primario, sí plantea la importancia de considerar cuidadosamente la probabilidad de éxito en grupos específicos de pacientes con FA e IC.
En un estudio posterior “A Randomized Trial to Assess Catheter Ablation Versus Rate Control in the Management of Persistent Atrial Fibrillation in Chronic Heart Failure” (ARC-HF) publicado en 201338, aleatorizado 52 pacientes, se asignaron los adultos con IC sintomática, FEVI ≤35%, y FA persistente a someterse a la ablación por catéter o control de la frecuencia. El punto final primario fue un cambio a los 12 meses en el consumo máximo de oxígeno. Los puntos finales secundarios fueron calidad de vida, péptido natriurético tipo B, distancia de caminata de 6 minutos y FEVI. Los resultados fueron analizados por intención de tratar. A los 12 meses, el 88% de los pacientes con ablación mantuvieron el ritmo sinusal (éxito en un solo procedimiento del 68%). El criterio de valoración primario, el consumo máximo de oxígeno, aumentó significativamente en el brazo de ablación en comparación con el control de la frecuencia (diferencia +3,07 ml / kg / min, intervalo de confianza del 95%: 0,56 a 5,59, p = 0,018). El cambio no fue evidente a los 3 meses (+0.79 ml / kg / min, intervalo de confianza del 95%: -1.01 a 2.60, p = 0.38). La ablación mejoró el puntaje de Minnesota (p = 0.019) y el péptido natriurético de tipo B (p = 0.045) y mostró tendencias no significativas hacia una mejor distancia de caminata de 6 minutos (p = 0.095) y FEVI (p = 0.055). Este primer ensayo aleatorizado de ablación versus control de frecuencia para centrarse en el rendimiento objetivo del ejercicio en la FA y la IC muestra un beneficio significativo de la ablación, una estrategia que también mejora los síntomas y el estado neurohormonal.
Un ensayo “A randomized controlled trial of catheter ablation versus medical treatment of atrial fibrillation in heart failure” (CAMTAF)39 publicado en 2014 incluyó una mayor proporción de pacientes con miocardiopatía no isquémica (74%) en comparación con los ensayos anteriores, mientras que el 92% de todos los pacientes en el estudio tenían FA persistente de larga duración. Además, se excluyó a aquellos pacientes que se creía claramente sintomáticos de FA (palpitaciones o mareos) ya que el objetivo del estudio era utilizar la ablación para tratar la insuficiencia cardíaca en lugar de la FA refractaria sintomática. Los pacientes con FA persistente, insuficiencia cardíaca sintomática y FEVI<50% fueron asignados al azar a la ablación con catéter o al control de la frecuencia médica. El punto final primario fue la diferencia entre los grupos en la fracción de eyección del VI a los 6 meses. La fracción de eyección del VI basal fue del 32 ± 8% en el grupo de ablación y del 34 ± 12% en el grupo médico, 26 pacientes fueron sometidos a ablación con catéter y 24 pacientes fueron controlados por frecuencia. La liberación de FA se logró en 21/26 (81%) a los 6 meses sin medicamentos antiarrítmicos. La fracción de eyección del VI a los 6 meses en el grupo de ablación fue del 40 ± 12% en comparación con el 31 ± 13% en el grupo de control de la frecuencia (P = 0,015). La ablación se asoció con un mejor consumo máximo de oxígeno (22 ± 6 versus 18 ± 6 ml / kg por minuto; P = 0.014) y Minnesota (24 ± 22 versus 47 ± 22; P = 0.001) en comparación con el control de frecuencia. Se observó una mejora en la FEVI, el consumo máximo de oxígeno y la puntuación de la calidad de vida en el brazo de ablación versus el control de la frecuencia farmacológica. Curiosamente, la duración de la FA fue significativamente menor en el estudio CAMTAF en comparación con la del estudio de MacDonaldy col. (24 meses versus 53 meses).
En el estudio randomizado multicéntrico de ablación “Ablation Versus Amiodarone for Treatment of Persistent Atrial Fibrillation in Patients With Congestive Heart Failure and an Implanted Device” (AATAC)40, los pacientes con FA persistente, FEY<40% e IC NYHA Clase II-III fueron aleatorizados (relación 1: 1) a someterse a ablación por catéter (grupo 1, n = 102) o recibir amiodarona (grupo 2, n = 101). A diferencia de los ensayos clínicos anteriores, el objetivo en ambos brazos era el control del ritmo con un punto final primario de recurrencia de FA y puntos finales secundarios, incluida la mortalidad por todas las causas y la hospitalización no planificada. Curiosamente, la ablación con catéter fue superior a la amiodarona para lograr evitar la recurrencia de la FA, así como reducir la mortalidad por todas las causas y las tasas de hospitalización no planificada. Durante un período de seguimiento más largo de 24 meses, el 70% de los pacientes en el brazo de ablación (IC 95% [60-78]) y el 34% en el brazo Amiodarona (IC 95% [25-44]) permanecieron libres de arritmia. Durante el seguimiento de 2 años, la tasa de hospitalización no planificada fue (32 [31%] en el grupo 1 y 58 [57%] en el grupo 2; P <0,001), mostrando una reducción del riesgo relativo del 45% (riesgo relativo, 0,55; Intervalo de confianza del 95%, 0,39-0,76). Se observó una mortalidad significativamente menor en ablación por catéter (8 [8%] versus amiodarona (18 [18%]; P = 0.037). La tasa de éxito de la ablación en los diferentes centros después de un solo procedimiento osciló entre 29% y 61%. La duración de la FA en la asignación al azar fue significativamente más corta que en estudios anteriores (8,6 meses en el brazo de ablación y 8,4 meses en el brazo de amiodarona), mientras que todos los pacientes tenían un dispositivo implantado, lo que fortaleció la calidad de los datos de resultado.
Aunque prometedor, debe tenerse en cuenta que el estudio AATAC comparó la ablación con un medicamento que se sabe que tiene toxicidades significativas; En el 10,4% de los fracasos del tratamiento en el grupo de amiodarona se retiró el medicamento debido a los efectos adversos. Sin embargo, el estudio plantea la importancia del tratamiento temprano antes de que se desarrolle una FA persistente de larga duración.
En estos ensayos clínicos la duración del seguimiento varió de 6 a 10 meses. Mientras tanto, las tasas de éxito de un solo procedimiento de ablación con catéter oscilaron entre 38 y 71%, con tasas de éxito generales entre 50 y 88%. En estos resultados no están claros si la ablación con catéter mantuvo el ritmo sinusal a largo plazo. Un metanálisis de Al Halabi S. y col. 41 de estos ensayos reveló que una mejora en la FEVI fue el beneficio más consistente en el resultado funcional con una diferencia media del 8,53% (IC del 95% [6,40-10,67]). Esto plantea la cuestión de si la ablación con catéter mejoraría el resultado funcional en pacientes con IC y FEVI preservada con datos limitados que sugieren que estos pacientes pueden ser mayores, tener más comorbilidades, ser más comúnmente mujeres y tener procedimientos con complicaciones asociadas.
En el estudio “Catheter Ablation Versus Medical Rate Control in Atrial Fibrillation and Systolic Dysfunction” (CAMERA-MRI) publicado en 2017 42, los pacientes con miocardiopatía idiopática y FA persistente se aleatorizaron para someterse a ablación con catéter o control de frecuencia médica. Todos los pacientes se sometieron a una resonancia magnética cardíaca al inicio del estudio después de la optimización del control de la frecuencia para evaluar la FEVI y la presencia de realce tardío de gadolinio, un sustituto de la fibrosis ventricular. Estos pacientes eran más jóvenes (edad media 59 ± 11 años en el brazo de ablación y 62 ± 9,4 años en el brazo de terapia médica) y tenían una FEVI media del 35%, pero una gran mayoría (72-76%) tenía FA persistente de larga evolución. El resultado primario fue un cambio en la FEVI durante una resonancia magnética repetida a los 6 meses. El grupo de ablación tuvo una mejoría en la FEY en comparación con el control de la frecuencia, pero, lo que es más interesante, entre los pacientes sometidos a ablación con catéter, aquellos que fueron negativos con realce tardío de gadolinio al inicio del estudio tuvieron una respuesta aún mejor en comparación con aquellos que tenían evidencia de realce tardío en la resonancia magnética. El verdadero valor de CAMERA-MRI puede ser que las herramientas de estratificación del riesgo, como la resonancia magnética cardiaca con realce tardío con gadolinio, podrían identificar una cohorte de pacientes que pueden ser súper respondedores a la ablación con catéter. Sin embargo, no está claro si la ablación mejora los resultados más allá de la función del ventrículo izquierdo en el Estudio CAMERA-MRI ya que no hubo datos sobre hospitalizaciones relacionadas con IC o mortalidad en esta cohorte.
Más recientemente, se han publicado varios ensayos muy esperados que evalúan puntos finales difíciles como la mortalidad. En este contexto, el ensayo de ablación con catéter versus terapia convencional estándar “Catheter Ablation for Atrial Fibrillation with Heart Failure” (CASTLE-AF) 43 evaluó el impacto de la ablación en la mortalidad y las tasas de progresión de la IC. Fue un estudio con un diseño prospectivo, multicéntrico, aleatorizado, controlado, realizado en 31 hospitales de 9 países de Estados Unidos, Europa y Australia. En este estudio, 363 pacientes con FA paroxística o persistente sintomática, IC NYHA II – IV, FEVI<35% y un dispositivo implantado fueron aleatorizados para recibir ablación con catéter o terapia médica (con control de ritmo). Durante una mediana de seguimiento de 37.8 meses, el punto final compuesto primario (muerte u hospitalización por empeoramiento de la insuficiencia cardíaca) ocurrió significativamente menos en el grupo de ablación que en el grupo de terapia médica (51 pacientes [28.5%] vs. 82 pacientes [44.6%]; cociente de riesgos, 0,62; intervalo de confianza [IC] del 95%, 0,43 a 0,87; p = 0,007); El número de pacientes que necesitarían tratamiento para prevenir el punto final primario a los 36 meses fue de 8.3. En los puntos secundario hubo 24 muertes en el grupo de ablación y 46 muertes en el grupo de terapia médica, con tasas de 13.4% y 25.0%, respectivamente (razón de riesgo por regresión de Cox, 0.53; IC 95%, 0.32 a 0.86; P = 0.01), hubo 37 pacientes con ingresos relacionados con la insuficiencia cardíaca en el grupo de ablación y 66 pacientes en el grupo de terapia médica, con tasas de 20,7% y 35,9%, respectivamente (cociente de riesgo de evento en el modelo de regresión de Cox, 0,56; IC del 95% , 0,37 a 0,83; P = 0,004)y finalmente hubo 20 muertes cardiovasculares (11.2%) en el grupo de ablación y 41 (22.3%) en el grupo de terapia médica (cociente de riesgos, 0.49; IC 95%, 0.29 a 0.84; P = 0.009). Las curvas de Kaplan-Meier para todas las causas de mortalidad tardaron 3 años en separarse, mientras que las curvas para admisiones de IC se separaron a los 6 meses. (Figura 3). De manera similar al ensayo AATAC, a todos los pacientes se les monitorizó la recurrencia de FA con un dispositivo implantado. También se demostró un beneficio de mortalidad (13.4% versus 25%; HR 0.53; IC 95% [0.32-0.86]; p = 0.01) en el brazo de ablación, que fue impulsado por una tasa más baja de muerte cardiovascular. El estudio CASTLE-AF se basa en la evidencia acumulada de que la ablación con catéter puede tener beneficios en pacientes con IC, pero no necesariamente agrega claridad sobre qué pacientes con insuficiencia cardíaca deben ser objeto de ablación. Los pacientes parecían estar altamente seleccionados con más de 3000 seleccionados para la elegibilidad, pero solo el 13.2% finalmente se inscribió. Se excluyeron los pacientes cuyo dispositivo implantado era de un proveedor diferente (estudio patrocinado por Biotronik) (32,4%). Entre el grupo de ablación, el 69% tenía IC de clase I o II de la NYHA, el 40% tenía miocardiopatía isquémica y el 30% tenía FA paroxística. La FA persistente de larga duración se observó en el 28% de los pacientes en el brazo de ablación y el 30% en el brazo de terapia médica. Esto revela claramente una cohorte altamente heterogénea de pacientes con insuficiencia cardíaca. También hubo una heterogeneidad significativa en términos del procedimiento de ablación con catéter en sí mismo con el objetivo de aislar todas las venas pulmonares y lograr el ritmo sinusal. A discreción del operador, se permitieron lesiones adicionales que involucraban el istmo cavotricuspídeo, el techo, la vena cava superior y la vena cava inferior.
Aunque prometedores, los resultados de CASTLE-AF pueden no aplicarse a pacientes asintomáticos con insuficiencia cardíaca, pacientes mayores (con una mediana de edad de 64 años en el estudio), así como a pacientes con insuficiencia cardíaca avanzada. De hecho, existe evidencia que sugiere que algunos grupos de pacientes con IC responden mucho mejor a la ablación con catéter.
Las tasas de complicaciones relacionadas con el procedimiento de ablación con catéter también pueden ser más altas en pacientes con insuficiencia cardíaca en comparación con las cohortes generales de pacientes que se someten a una ablación de FA, lo que se tiene en cuenta durante la selección del paciente. En el estudio CASTLE-AF, las complicaciones relacionadas con el procedimiento o los eventos adversos graves ocurrieron en 7.8%, mientras que en una cohorte contemporánea de pacientes generales sometidos a ablación de FA la tasa de complicaciones fue de 2.3%. 44
El último estudio publicado CABANA en este año 2019 (CatheterAblation versus AntiarrhythmicDrugTherapyfor Atrial Fibrillation)45 genero una intensa discusión en el mundo. El ensayo clínico randomizado mostró que la ablación por catéter no es superior a la medicación antiarrítmica en pacientes con FA de reciente aparición o que necesitan tratamiento médico. Lanzado en 2009 y realizado en más de 140 centros de distintos países, el estudio reclutó a 2.200 pacientes con fibrilación auricular paroxística o persistente de 67 años en promedio. El ensayo consistió en realizar una ablación a un grupo de participantes, mientras que se suministraban los mejores fármacos para controlar el ritmo o la frecuencia cardíaca al otro grupo. Tras cinco años de seguimiento, los investigadores no encontraron diferencias significativas en el punto final primario, integrado por muerte, ACV invalidante, hemorragia severa o paro cardíaco (HR 0,86; p: 0,3). Las cifras de mortalidad fueron 5,2% para ablación vs 6,1% para terapia farmacológica (p 0,38). En cuanto al ACV discapacitante, la comparación fue de 0,3% vs 0,6% (p 0,19). Respecto de los puntos secundarios, hubo 51,7% de mortalidad por todas las causas u hospitalización por causa cardiovascular en el grupo de ablación, mientras que en los pacientes que recibieron medicación el porcentaje fue de 59,1%. La recurrencia de las arritmias fue 47% menor en quienes recibieron ablación. El estudio presento problemas metodológicos de diseño y análisis que podrían explicar los resultados. Para empezar, el punto primario fue cambiado en la mitad del estudio (2013), debido a la lenta incorporación de pacientes y las pocas muertes registradas. Se pasó así del objetivo de mortalidad global a un compuesto de eventos cardiovasculares. Además, el estudio no fue hecho a ciegas y los pacientes asignados a ablación pudieron pasar al grupo de medicación antiarrítmica, y viceversa. Sólo el 90,8% de los pacientes asignados a ablación finalmente la recibieron. Y, si bien 99,6% de los asignados al mejor tratamiento farmacológico recibieron las drogas, un 27,5% cruzó al grupo de ablación. Al analizar las cifras finales, se observó que 1.307 pacientes habían recibido finalmente una ablación, mientras que 897 recibieron sólo medicación. Al hacer un análisis por protocolo, los investigadores del CABANA encontraron que el resultado compuesto primario se redujo del 10,9% en el grupo de fármacos al 7% en el grupo de ablación (HR 0.67, CI 0.50-0.89, p=0.006). La mortalidad por todas las causas también disminuyó del 7.5% al 4.4%. Por otra parte, un análisis de subgrupos mostró que los menores de 65 años obtuvieron más beneficios que los mayores de 75, para quienes la ablación no resolvió mayormente la fibrilación auricular. Los pacientes con insuficiencia cardíaca mostraron una tendencia a mejores resultados con la ablación que con la medicación. En este sentido, el estudio CASTLE-AF mostro una disminución de la mortalidad en este tipo de pacientes.
4.5 Ablación nodal AV y terapia de resincronización cardiaca
La ablación nodal AV y la estimulación permanente es el último recurso para lograr la sincronía AV en pacientes con FA e IC que fracasan en todos los demás intentos de control de la frecuencia o el ritmo. Muchos de estos pacientes sometidos a ablación del nodo AV requerirán la implantación de terapia de resincronización cardiaca (TRC). La TRC es una opción terapéutica establecida para un grupo selecto de pacientes con disfunción severa del ventrículo izquierdo y un QRS amplio que no responden a la terapia médica óptima para la insuficiencia cardíaca. Se ha demostrado que la mejora de la función cardíaca, la restauración de la sincronía auriculoventricular e interventricular y la mecánica de aurícula izquierda con TRC se correlacionan con una menor incidencia de FA. 46La aparición de FA en pacientes con IC que reciben un dispositivo TRC da como resultado la pérdida del beneficio de resincronización derivado con una tasa más alta de no respondedores (35% con FA frente a 28% sin FA, p = 0.001)47. Un gran porcentaje de pacientes con FA e IC que reciben TRC requerirán ablación del nodo AV para una resincronización adecuada.
Un metaanálisis de 450 pacientes con insuficiencia cardíaca y FA concomitantes de 3 ensayos no aleatorios concluyó que la ablación del nodo AV se asoció con reducciones en la mortalidad por todas las causas (razón de riesgo [RR], 0,42; p <0,001) y mortalidad cardiovascular (RR , 0,44; p = 0,008). 97) Aunque Manolisy col. Mostraron una mejoría inicial en los síntomas de la insuficiencia cardíaca, la función del VI y la clase funcional de la NYHA.48 después de la ablación del nódulo AV y la implantación de un marcapasos permanente ventricular derecho, los resultados a largo plazo no han sido favorables en comparación con los pacientes que se sometieron a ablación por catéter por FA. 49Los resultados clínicos de los pacientes con FA, ablación del nodo AV y estimulación biventricular fueron similares a los de resincronización cardíaca y RS normal. 50
4.6 PERSPECTIVAS FUTURAS
A pesar del progreso significativo en la ablación con catéter en pacientes con IC, aún quedan varias preguntas sin responder, incluidos los medios óptimos de estratificación del riesgo de los pacientes para ablación por IC y FA, la técnica de ablación óptima y el momento de la ablación con catéter. Tampoco está claro si la intervención será rentable si los pacientes requieren ablaciones múltiples, particularmente a medida que avanza la IC. Actualmente se están llevando a cabo una serie de ensayos clínicos que pueden proporcionar alguna aclaración. El ensayo de ablación de fibrilación auricular en pacientes con insuficiencia cardíaca (CONTRA-HF) investigará el impacto de la ablación pacientes con insuficiencia cardíaca y dispositivos cardíacos implantados / terapias de resincronización cardíaca (NCT03062241) Se espera una mejor reproducibilidad del procedimiento de ablación en sí mismo en el brazo de ablación y su impacto en puntos finales difíciles como la mortalidad será bienvenido.
El ensayo de ablación con catéter versus terapia médica en pacientes con IC y FA (CATCH-AF) evaluará el impacto de la ablación con catéter en pacientes con FA sintomática recién diagnosticada con el objetivo de ayudar a los electrofisiólogos a comprender los beneficios de la ablación de FA temprana (NCT02686749). El ensayo de Manejo de la fibrilación auricular en la insuficiencia cardíaca congestiva con ablación (AMICA) investigará si la ablación por catéter sola en pacientes con FA persistente o FA persistente prolongada mejora los resultados en comparación con la mejor terapia médica (NCT00652522). Esto permitirá investigar el impacto de un procedimiento estandarizado en un grupo de pacientes menos heterogéneo.
El ensayo aleatorizado de control de ritmo de fibrilación auricular basado en la ablación en pacientes con insuficiencia cardíaca y fibrilación auricular (RAFT-AF) evaluará la relación costo-efectividad de una estrategia de ablación en pacientes con insuficiencia cardíaca y evaluará puntos finales difíciles, incluida la mortalidad por todas las causas; los pacientes con insuficiencia cardíaca se estratificarán de acuerdo con aquellos con ICFRE y ICFEF (NCT01420393 ).
El advenimiento de la estimulación permanente del haz de His para preservar la conducción fisiológica de los ventrículos y permitir un medio para lograr la terapia de resincronización cardíaca también podría ofrecer una estrategia de manejo alternativa en grupos seleccionados de pacientes con FA e IC, si se combina con la ablación del nódulo AV. Se anticipan más estudios para evaluar los resultados clínicos utilizando esta estrategia.
5 DISCUSIÓN
La fibrilación auricular a menudo coexiste con la insuficiencia cardiaca compartiendo factores de riesgo en común, así como los mecanismos fisiopatológicos. Como vimos previamente no hubo diferencias estadísticamente significativas en los ensayos clínicos de control del ritmo vs control de frecuencia. La ablación por catéter puede usarse para tratar la FA en paciente con IC. Le la restauración del ritmo sinusal con control de ritmo valido para métodos farmacológicos o por ablación se basa en la creencia de que restaurar la patada auricular mejora la función sistólica, sin embargo, no está claro si esto será beneficioso ¿Por qué el llenado adicional al final de la diástole sería beneficioso una vez que la aurícula y el ventrículo izquierdo están dilatados y las presiones de fin de diástole están elevadas? Como pudimos ver el tratamiento ineficiente de la FA puede desarrollar taquiarritmias auriculares que generan taquicardiomiopatia y fibrosis cardiaca. La ablación con catéter es una estrategia de control del ritmo de vanguardia para pacientes con FA no permanente sin los efectos adversos de los fármacos antiarrítmicos. Algunos estudios observacionales, ensayos controlados aleatorios y metanálisis demostraron que la ablación por catéter mejoró la función cardíaca y la tolerancia al ejercicio en comparación con la estrategia de control de frecuencia. Por lo tanto, se debe considerar la ablación en pacientes con FA e IC para aliviar los síntomas cuando se sospecha taquicardiomiopatía. Sin embargo, se desconocen los efectos de la ablación por catéter en los puntos finales duros. Encontramos que la ablación de FA fue efectiva y segura en estos pacientes. La ablación redujo los riesgos de mortalidad por todas las causas y reingreso de insuficiencia cardíaca, pero no previno el accidente cerebrovascular, en pacientes seleccionados. La ablación se relacionó con un aumento de la FEVI y una reducción del volumen del ventrículo izquierdo, lo que en consecuencia resultó en una mejor función cardíaca. Mientras tanto, la ablación por catéter alivió los síntomas de IC, aumentó la tolerancia al ejercicio y mejoró la calidad de vida.
La mayoría de los pacientes incluidos en los estudios presentaban FA persistente. La proporción de pacientes en ritmo sinusal después del procedimiento inicial fue relativamente baja, pero al realizar más de una ablación aumentó la proporción de pacientes libres de FA, Además, los resultados indicaron que se debe considerar un procedimiento repetido en pacientes con insuficiencia cardíaca con FA recurrente para lograr el ritmo sinusal. Se vio que el riesgo de complicaciones del procedimiento era relativamente bajo, lo que indica que la ablación era segura en pacientes con insuficiencia cardíaca. Sin embargo, el número de pacientes inscritos en estos estudios fue pequeño y no informaron los efectos de la ablación en los puntos finales duros, como la mortalidad y el reingreso por insuficiencia cardíaca.
Estos estudios carecían de datos individuales específicos para realizar análisis de subgrupos basados en la edad, el sexo y las enfermedades basales. Pero la heterogeneidad de la mayoría de los análisis fue pequeña y no hubo necesidad de explorar la fuente de la heterogeneidad. Además, la FEVI basal se midió con ritmo de FA en los estudios incluidos y la ecocardiografía se utilizó en la mayoría de los ensayos lo que significaba una precisión relativamente baja y una repetibilidad deficiente. Sin embargo, la medida de FEVI al final del seguimiento fue relativamente precisa porque la mayoría de los participantes en el grupo de ablación por catéter estaban en ritmo sinusal. Esto puede provocar errores en la comparación desde la línea de base hasta el final del seguimiento.
El control del ritmo con fármacos antiarrítmicos no mejoró los resultados en comparación con el control de la frecuencia en el ensayo AFFIRM. El grado de control del ritmo alcanzado con los fármacos antiarrítmicos es subóptimo y pueden tener varios efectos secundarios. Además, se ha demostrado que la ablación con catéter mejora el estado funcional y la calidad de vida, además de reducir las hospitalizaciones, la ablación con catéter es un procedimiento relativamente seguro con una baja incidencia de eventos adversos importantes. El beneficio potencial de la ablación con catéter en pacientes con FA y función del VI conservada no se ha aclarado por completo. La evidencia reciente ha demostrado que las complicaciones de la FA se extienden más allá del accidente cerebrovascular e incluyen un mayor riesgo de mortalidad, infarto de miocardio, así como una mayor incidencia de insuficiencia cardíaca y hospitalizaciones.
Es de destacar que una limitación importante de este análisis y la literatura actual es la ausencia de ensayos clínicos con evaluación de resultados clínicos a largo plazo que comparen la ablación con catéter con una estrategia de control de frecuencia pura, es decir, excluir completamente el uso de antiarrítmicos. Por lo tanto, el ensayo aleatorio RAFT-AF (NCT01420393), que evaluará el resultado a largo plazo de la ablación con catéter en comparación con la terapia de control de frecuencia, excluyendo el uso de antiarrítmicos como la amiodarona, arrojará luz importante sobre este importante tema.
Hubo varias otras limitaciones a nuestros análisis. En primer lugar, el número de estudios y pacientes incluidos es relativamente pequeño, lo que enfatiza la necesidad de estudios más grandes en esta población de pacientes. El pequeño número de estudios impide un análisis efectivo del sesgo de publicación para comprender mejor los factores asociados con estos resultados. En segundo lugar, la ausencia de datos a nivel del paciente nos impidió identificar las características del paciente que pueden asociarse con mejores resultados. En tercer lugar, hubo una variación significativa en la duración del seguimiento con solo tres estudios con más de un año de seguimiento. Por lo tanto, no pudimos evaluar el beneficio de la ablación con catéter más allá de un año de seguimiento. Cuarto, la clase media de la NYHA fue de 2.5 y la FEY media fue del 30%; por lo tanto, no está claro si estos hallazgos son aplicables a pacientes con FEY severamente disminuida y aquellos con NYHA clase III-IV. En quinto lugar, todos los pacientes incluidos en los ensayos informados por Di Biase et al. y Marrouche et al. tenían un desfibrilador implantable. Si bien esta terapia se basa en pautas y permite el monitoreo continuo de la recurrencia de arritmia, no está claro si la ablación con catéter también es beneficiosa en pacientes sin un desfibrilador implantable, especialmente dado que ya no puede indicarse si la FEVI mejora después de la ablación con catéter. Esta pregunta clínica también debe ser respondida por el estudio RAFT-AF (NCT01420393). Finalmente, los resultados de nuestros hallazgos pueden ser aplicables solo a centros de ablación con catéter de gran volumen, ya que la mayoría de los centros que participaron en los ensayos clínicos eran instituciones con experiencia en esta técnica dado que la inexperiencia en la ejecución del procedimiento puede implicar mayor tasa de complicaciones que contrarreste un potencial beneficio clínico.
Sin embargo, hay que tener en cuenta que cualquier beneficio informado por el paciente puede estar relacionado con el impacto psicológico del procedimiento, con los beneficios fisiológicos de la restauración del ritmo sinusal o cambios concomitantes en la terapia médica para la insuficiencia cardíaca. La ablación con catéter es un procedimiento invasivo que se realiza de manera diferente por cada médico tratante, y conlleva riesgos de complicaciones mayores. En pacientes con insuficiencia cardíaca leve y jóvenes, como hemos visto la media de edad de los ensayos clínicos de 65 años, la ablación es generalmente exitosa para lograr el ritmo sinusal, pero a menudo se requiere un segundo o tercer procedimiento. La medición de la FEVI por ecocardiografía no es confiable en pacientes con FA, particularmente en ausencia de cegamiento; sin embargo, los 2 ensayos más grandes evaluaron la FEVI por este método. Debido a las limitaciones de la ecocardiografía, 2 ensayos evaluaron la FEVI utilizando resonancia magnética cardíaca. La CAMARA-MRI informó un aumento en la FEVI, pero los pacientes en el ensayo no tenían insuficiencia cardíaca significativa; su tolerancia al ejercicio fue preservada y sus niveles de péptidos natriuréticos fueron consistentes con los observados en FA en ausencia de IC. Por el contrario, MacDonald et al no informaron un aumento significativo en la FEY en pacientes con IC bien establecida (NTproBNP [péptido natriurético pro-B tipo N-terminal] ≈2200 pg / ml y FEY basal del 18%) Todos los ensayos informaron los efectos de la ablación con catéter en tolerancia al esfuerzo y calidad de vida. Aunque a menudo se evalúa por diferentes métodos, varios ensayos observaron mejor rendimiento en el ejercicio. Sin embargo, estos hallazgos son difíciles de interpretar porque los ensayos no fueron cegados, y se sabe que el conocimiento de la asignación del tratamiento sesga estas evaluaciones.
En CASTLE-AF hubo desequilibrios significativos a través de los grupos de tratamiento en la aleatorización; 20% de todos los pacientes asignados al azar no se incluyeron en el análisis primario; el ensayo se detuvo por inutilidad y solo logró el 70% del número planificado de eventos de punto final primario. El aumento inexplicable de las hospitalizaciones no cardiovasculares en el grupo de ablación también plantea preocupaciones sobre la falta de cegamiento en la notificación de causas específicas de admisiones. En ambos ensayos los pacientes que recibieron tratamiento farmacológico antiarrítmico que se ha relacionado con un mayor riesgo de mortalidad cuando se usa para tratar la FA en pacientes con insuficiencia cardíaca. La totalidad de la evidencia sugiere que la ablación con catéter para la FA puede tener beneficios en la FEVI y la capacidad funcional en la insuficiencia cardíaca crónica. Sin embargo, los ensayos han sido pequeños y enfocado principalmente en pacientes con insuficiencia cardíaca mínima o leve y solo deterioro moderado de la función del ventrículo izquierdo. En pacientes con grados significativos de IC y baja FEVI, se ha observado poca eficacia y la tasa de complicaciones ha sido más elevadas. La escasa cantidad de eventos, la gran cantidad de pacientes excluidos o perdidos en el seguimiento, la falta de equilibrio en la aleatorización y el uso de grupos de comparación que fueron tratados con fármacos antiarrítmicos para lograr el control del ritmo, hace que no sea posible sugerir un beneficio en la morbimortalidad en paciente randomizados a la ablación con catéter. Por lo tanto, ensayos controlados aleatorios adicionales son necesarios para comprender el rango de posibles respuestas a este procedimiento. Tales ensayos deberían enfocarse en pacientes con grados significativos de IC y FA de larga data e incluir pacientes con FEVI severa (especialmente <30%).
6 CONCLUSIONES
La FA y la IC han surgido como una epidemia compleja y creciente, con una morbilidad y mortalidad cardiovascular significativas. Las dos entidades se complementan en los efectos deletéreos que producen, así como comparten factores de riesgo, fisiopatología y progresión. Son dos epidemias crecientes que continuarán coexistiendo con frecuencia a medida que nuestra población envejece. Estas condiciones pueden exacerbarse entre sí y su combinación conduce a una mayor morbilidad y mortalidad. En pacientes con FA e IC, además de la anticoagulación y la terapia estándar de IC, es extremadamente importante instituir intentos agresivos de control de la frecuencia y / o el ritmo, ya que una proporción de estos pacientes tendrá IC mediada por FA y taquicardiomiopatía y otros tendrán IC que puede ser empeorada por la FA. Con opciones limitadas en términos de terapia médica para lograr un control exitoso de la FA en la IC, el control del ritmo mediante ablación con catéter tiene potencial hacia resultados favorables en esta población de pacientes. Por lo tanto, ha habido un cambio hacia la búsqueda de una intervención temprana con la ablación con catéter para restaurar el ritmo sinusal como hemos visto en pacientes jóvenes con una edad mediana de 65 años e IC. El manejo médico óptimo de la insuficiencia cardíaca puede proteger contra la aparición de FA y las terapias dirigidas a la FA pueden prevenir el desarrollo de insuficiencia cardíaca congestiva. El debate entre un control de frecuencia y una estrategia de control de ritmo ahora se alimenta con nuevos estudios que comparan el control de frecuencia con la ablación con catéter, lo que aumenta potencialmente la eficacia del control de ritmo y minimiza los efectos secundarios relacionados con los medicamentos antiarrítmicos. Nuestra elección de agentes antiarrítmicos sigue siendo limitada en esta población enferma debido a sus efectos nocivos. Se necesitan más datos para guiar nuestra toma de decisiones en el uso apropiado de la ablación con catéter en esta población de pacientes. Todavía queda mucho trabajo por hacer para definir la terapia farmacológica y / o de intervención óptima para pacientes con FA e IC. La estrecha colaboración interdisciplinaria entre cardiólogos, especialistas en IC y electrofisiólogos es esencial para lograr buenos resultados a largo plazo en esta población desafiante.
7 Bibliografía
1. Braunwald E. Tratado de Cardiologia. Volumen 2. 10ma ed. Barcelona. Elsevier, 2016.
2.Chugh SS, Havmoeller R, Narayanan K et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 2014;129:837–47.
2. Santhanakrishnan R, Wang N, Larson MG et al. Atrial fibrillation begets heart failure and vice versa: temporal associations and differences in preserved versus reduced ejection fraction. Circulation. 2016;133:484–92.
4. Li D, Shinagawa K, Pang L, Leung TK, Cardin S, Wang Z, Nattel S. Effects of angiotensin-converting enzyme inhibition on the development of the atrial fibrillation substrate in dogs with ventricular tachypacing-induced congestive heart failure. Circulation 2001;104:2608 –2614
5. Deedwania PC, Lardizabal JA. Atrial fibrillation in heart failure: a comprehensive review. Am J Med 2010;123:198 –204.
6. . Nerheim P, Birger-Botkin S, Piracha L, Olshansky B. Heart failure and sudden death in patients with tachycardia-induced cardiomyopathy and recurrent tachycardia. Circulation 2004;110:247 – 252
7. Luchsinger J A, Steinberg J S. Resolution of cardiomyopathy after ablation of atrial flutter. J. Am. Coll. Cardiol. 1998 Jul;32
8. Redfield M M, Kay G N, Jenkins L S, Mianulli M, Jensen D N, Ellenbogen K A. Tachycardia-related cardiomyopathy: a common cause of ventricular dysfunction in patients with atrial fibrillation referred for atrioventricular ablation. Mayo Clin. Proc. 2000 Aug
9. Edner M, Caidahl K, Bergfeldt L, Darpö B, Edvardsson N, Rosenqvist M. Prospective study of left ventricular function after radiofrequency ablation of atrioventricular junction in patients with atrial fibrillation. Br Heart J. 1995 Sep;74
10. Gentlesk Philip J, Sauer William H, Gerstenfeld Edward P, Lin David, Dixit Sanjay, Zado Erica, Callans David, Marchlinski Francis E. Reversal of left ventricular dysfunction following ablation of atrial fibrillation. J. Cardiovasc. Electrophysiol. 2007 Jan
11. Carson PE, Johnson GR, Dunkman WB, Fletcher RD, Farrell L, Cohn JN. The influence of atrial fibrillation on prognosis in mild to moderate heart failure. The V-HeFT Studies. The V-HeFT VA Cooperative Studies Group. Circulation. 1993
12. Dries D L, Exner D V, Gersh B J, Domanski M J, Waclawiw M A, Stevenson L W. Atrial fibrillation is associated with an increased risk for mortality and heart failure progression in patients with asymptomatic and symptomatic left ventricular systolic dysfunction: a retrospective analysis of the SOLVD trials. Studies of Left Ventricular Dysfunction. J. Am. Coll. Cardiol. 1998 Sep
13. Olsson LG, Swedberg K, Ducharme A, et al. Atrial fibrillation and risk of clinical events in chronic heart failure with and without left ventricular systolic dysfunction: results from the Candesartan in Heart failure-Assessment of Reduction in Mortality and morbidity (CHARM) program. J Am Coll Cardiol. 2006
14. Køber L1, Torp-Pedersen C, et al. A clinical trial of the angiotensin-converting-enzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infarction. Trandolapril Cardiac Evaluation (TRACE) Study Group. N Engl J Med. 1995 Dec 21
15. Chamberlain Alanna M, Redfield Margaret M, Alonso Alvaro, Weston Susan A, Roger Véronique L. Atrial fibrillation and mortality in heart failure: a community study. Circ Heart Fail. 2011 Nov;4 (6):740–6.
16.Trulock KM, Narayan SM, Piccini JP. Rhythm control in heart failure patients with atrial fibrillation: contemporary challenges including the role of ablation. J Am Coll Cardiol 2014;64:710 – 721
17.Maisel William H, Stevenson Lynne Warner. Atrial fibrillation in heart failure: epidemiology, pathophysiology, and rationale for therapy. Am. J. Cardiol. 2003 Mar 20
18. Wyse D G, Waldo A L, DiMarco J P, Domanski M J, Rosenberg Y, Schron E B, Kellen J C, Greene H L, Mickel M C, Dalquist J E, Corley S D. A comparison of rate control and rhythm control in patients with atrial fibrillation. N. Engl. J. Med. 2002 Dec 05;347 (23):1825–33
19. Van Gelder Isabelle C, Hagens Vincent E, Bosker Hans A, Kingma J Herre, Kamp Otto, Kingma Tsjerk, Said Salah A, Darmanata Julius I, Timmermans Alphons J M, Tijssen Jan G P, Crijns Harry J G M. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N. Engl. J. Med. 2002 Dec 05;347 (23):1834–40.
20. Guglin M, Chen R, Curtis AB. Sinus rhythm is associated with fewer heart failure symptoms: insights from the AFFIRM Trial. Heart Rhythm. 2010;7:596–601.
21. Opolski Grzegorz, Torbicki Adam, Kosior Dariusz A, Szulc Marcin, Wozakowska-Kaplon Beata, Kolodziej Piotr, Achremczyk Piotr. Rate control vs rhythm control in patients with nonvalvular persistent atrial fibrillation: the results of the Polish How to Treat Chronic Atrial Fibrillation (HOT CAFE) Study. Chest. 2004 Aug;126 (2):476–86.
22. Carlsson Jörg, Miketic Sinisa, Windeler Jürgen, Cuneo Alessandro, Haun Sebastian, Micus Stefan, Walter Sabine, Tebbe Ulrich. Randomized trial of rate-control versus rhythm-control in persistent atrial fibrillation: the Strategies of Treatment of Atrial Fibrillation (STAF) study. J. Am. Coll. Cardiol. 2003 May 21;41 (10):1690–6.
23. Hohnloser S H, Kuck K H, Lilienthal J. Rhythm or rate control in atrial fibrillation–Pharmacological Intervention in Atrial Fibrillation (PIAF): a randomised trial. Lancet. 2000 Nov 25;356 (9244):1789–94.
24. Dyrda K, Roy D, Leduc H, et al. Treatment failure with rhythm and rate control strategies in patients with atrial fibrillation and congestive heart failure: an AF-CHF substudy. J Cardiovasc Electrophysiol. 2015;26:1327–1332.
25. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet. 1999 Jan 02;353 (9146):9–13.
26. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF) Lancet. 1999 Jun 12;353 (9169):2001–7.
27. Joglar J A, Acusta A P, Shusterman N H, Ramaswamy K, Kowal R C, Barbera S J, Hamdan M H, Page R L. Effect of carvedilol on survival and hemodynamics in patients with atrial fibrillation and left ventricular dysfunction: retrospective analysis of the US Carvedilol Heart Failure Trials Program. Am. Heart J. 2001 Sep;142 (3):498–501.
28. Swedberg K, Olsson LG, Charlesworth A, et al. Prognostic relevance of atrial fibrillation in patients with chronic heart failure on long-term treatment with beta-blockers: results from COMET. Eur Heart J. 2005;26:1303–1308.
29.Joglar JA, Acusta AP, Shusterman NH, et al. Effect of carvedilol on survival and hemodynamics in patients with atrial fibrillation and left ventricular dysfunction: retrospective analysis of the US Carvedilol Heart Failure Trials Program. Am Heart J. 2001;142:498–501.
30. Cadrin-Tourigny J, Shohoudi A, Roy D, et al. Decreased mortality with beta-blockers in patients with heart failure and coexisting atrial fibrillation: an AF-CHF substudy. JACC Heart Fail. 2017;5:99–106.
31. Petar M. Seferovic Piotr Ponikowski.¡ y col. Clinical practice update on heart failure 2019: pharmacotherapy, procedures, devices and patient management. An expert consensus meeting report of the Heart Failure Association of the European Society of Cardiology. 26 May 2019
32. Clyde W. Yancy, MD, MSc, MACC, et al.. 2017 ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure. August 2017Volume 23, Issue 8, Pages 628–651
33. iotr Ponikowski, Adriaan A. Voors y col. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal 2016.
34. Craig T. January , L. Samuel Wann , et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in Collaboration With the Society of Thoracic Surgeons. 28 Jan 2019.
35. Paulus Kirchhof, Stefano Benussi, y col. ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. 7 October 2016.
36. Khan MN, Jais P, Cummings J Pulmonary-vein isolation for atrial. N Engl J Med. 2008 Oct 23
37. MacDonald MR, Connelly DT, Hawkins NM et al. Radiofrequency ablation for persistent atrial fibrillation in patients with advanced heart failure and severe left ventricular systolic dysfunction: a randomised controlled trial. Heart. 2011;97:740–7.
38. Jones DG, Haldar SK, Hussain W et al. A randomized trial to assess catheter ablation versus rate control in the management of persistent atrial fibrillation in heart failure. J Am Coll Cardiol. 2013;61:1894–903.
39. Hunter RJ, Berriman TJ, Diab I et al. A randomized controlled trial of catheter ablation versus medical treatment of atrial fibrillation in heart failure (the CAMTAF trial) Circ Arrhythm Electrophysiol. 2014;7:31–8
40. Di Biase L, Mohanty P, Mohanty S et al. Ablation versus amiodarone for treatment of persistent atrial fibrillation in patients with congestive heart failure and an implanted device: results from the AATAC Multicenter randomized trial. Circulation. 2016;133:1637–44.
41. Al Halabi S, Qintar M, Hussein A et al. Catheter ablation for atrial fibrillation in heart failure patients: a meta-analysis of randomized controlled trials. JACC Clin Electrophysiol. 2015;1:200–9.
42. Prabhu S, Taylor AJ, Costello BT et al. Catheter ablation versus medical rate control in atrial fibrillation and systolic dysfunction: the CAMERA-MRI study. J Am Coll Cardiol. 2017;70:1949–61.
43. Marrouche NF, Brachmann J, Andresen D et al. Catheter ablation for atrial fibrillation with heart failure.CASTLE-AF N Engl J Med. 2018;378:417–27
44. . Muthalay RG, John RM, Schaeffer B Temporal trends in safety and complication rates of catheter ablation for atrial fibrillation. J Cardiovasc Electrophysiol. 2018; 29(6):854-860
45. Packer DL, Mark DB, Robb RA, et al.CABANA Investigators. Effect of catheter ablation vs antiarrhythmic drug therapy on mortality, stroke, bleeding, and cardiac arrest among patients with atrial fibrillation: the CABANA randomized clinical trial. JAMA.2019;321:1261–1274
46. Fung JW, Yip GW, Zhang Q, et al. Improvement of left atrial function is associated with lower incidence of atrial fibrillation and mortality after cardiac resynchronization therapy. Heart Rhythm. 2008;5:780–786.
47. Wilton SB, Leung AA, Ghali WA, Faris P, Exner DV. Outcomes of cardiac resynchronization therapy in patients with versus those without atrial fibrillation: a systematic review and meta-analysis. Heart Rhythm. 2011;8:1088–1094.
48.Ganesan AN, Brooks AG, Roberts-Thomson KC, Lau DH, Kalman JM, Sanders P. Role of AV nodal ablation in cardiac resynchronization in patients with coexistent atrial fibrillation and heart failure a systematic review. J Am Coll Cardiol. 2012;59:719–726.
49. Manolis AG, Katsivas AG, Lazaris EE, Vassilopoulos CV, Louvros NE. Ventricular performance and quality of life in patients who underwent radiofrequency AV junction ablation and permanent pacemaker implantation due to medically refractory atrial tachyarrhythmias. J Interv Card Electrophysiol. 1998;2:71–76.
50. Gasparini M, Leclercq C, Lunati M, et al. Cardiac resynchronization therapy in patients with atrial fibrillation: the CERTIFY Study (Cardiac Resynchronization Therapy in Atrial Fibrillation Patients Multinational Registry) JACC Heart Fail. 2013;1:500–506.
51. Zain Ul Abideen Asad, et al. Catheter Ablation Versus Medical Therapy for Atrial Fibrillation. A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Circ Arrhythm Electrophysiol. 2019;12-007414.