1) INTRODUCCIÓN
La enfermedad cardiovascular es la principal causa de muerte en países desarrollados y la muerte súbita representa el 60% de la mortalidad cardiovascular.1
Con las mejoras en las técnicas de resucitación, en el acceso rápido a la atención médica y la llegada de la unidad coronaria, la mortalidad del infarto de miocardio que era de 40% en 1960 (principalmente debido a arritmias ventriculares fatales) ha descendido a menos del 10%. Las arritmias graves en este contexto, aun después de pasada la fase aguda, despertaron el interés de Mirowski y Shuder que fueron los primeros en conceptualizar, desarrollar e implantar un desfibrilador transvenoso. Pese a que en su época había muchos detractores a la idea de implantar un dispositivo que trate arritmias, realizaron el primer implante en Febrero de 1980 a través de una toracotomía y con un equipo de gran tamaño que se colocaba en la zona abdominal. Este dispositivo no era programable, no tenía telemetría y no tenía marcapaseo.2
Este primer implante perseguía el objetivo solo de rescatar al paciente de un episodio de fibrilación ventricular. Con el correr de los años y el avance de la tecnología se incorporó el marcapaseo antitaquicardia además de la desfibrilación y se puede adaptar la programación del dispositivo de acuerdo al tipo arritmia e incluso a la condición clínica del paciente. 2
Casi dos décadas después, el cardiodesfibrilador implantable transvenoso (CDI-TV) demostró ser superior al tratamiento farmacológico en cuanto a la prevención de muerte súbita en pacientes con paro cardíaco reanimado (prevención secundaria) o con alto riesgo de muerte súbita por función ventricular deprimida o enfermedades genéticas que puedan generar arritmias fatales (prevención primaria). Hoy en día se considera al CDI TV como Gold Standard para la prevención de muerte súbita.3
Es importante destacar que las complicaciones más frecuentes asociadas al CDI son las asociadas al catéter transvenoso como veremos más adelante. Para tratar de evitar estas complicaciones, entre otros motivos, surge en el año 2008 el Cardiodesfibrilador totalmente Subcutáneo (CDI-S). 3
El objetivo de esta monografía es evaluar la eficacia y seguridad del CDI-S respecto al CDI-TV, evaluando a su vez las limitaciones del CDI-S y las probabilidades de resolución de las mismas a futuro.
2) METODOLOGÍA
Se realizó una búsqueda bibliográfica que incluyó revisiones sistemáticas, estudios observacionales, reporte de series de casos, guías de prácticas clínicas y estudios experimentales de laboratorio.
La búsqueda se realizó en bases de datos electrónicas: MEDLINE, Cochrane, Lilacs y Google Scholar. Se utilizaron las palabras clave totally subcutaneous desfibrillator, sudden cardiac death, intravascular lead related complications _
Además se utilizó la función de “artículos relacionados” de PUBMED y se realizó la búsqueda manual de citas bibliográficas consideradas relevantes.
Se revisó la evidencia científica desde las primeras publicaciones sobre el tema hasta la actualidad.
3) DESARROLLO
3.1 Sistema CDI-S
A diferencia del CDI-TV con catéter intravascular/intracardíaco, el CDI-S está equipado con un catéter extra cardíaco, y más precisamente extratorácico.
El CDI-S consta de (Ver Figura Nº 1 y 2):
- Un generador que es más grande y pesado (145 gr) que un CDI-TV bicameral que se inserta en una posición lateral izquierda, sobre la 6ta costilla, entre las líneas axilares anterior y media en el espacio donde se unen el musculo serrato mayor y el dorsal ancho. Este generador puede: emitir hasta cinco choques de alta energía (80J, casi el doble que los CDI-TV) de corriente bifásica por episodio y hacer un marcapaseo antibradicardia post choque a 50 latidos por minuto por 30 segundos si sensa una asistolia de más de 3,5 seg. En cuanto a la batería, la longevidad original estimada era de 5 años; se informó además en las primeras generaciones un agotamiento precoz de la batería que llegaba al 9% de los implantes. La segunda y tercera generación de dispositivos constan de un generador un 20% más delgado con una longevidad 40% mayor que la de su predecesor, estimándose una vida media de 7.3 años. 3
- Un único cable subcutáneo de 3 milímetros que se canaliza desde la cavidad lateral donde se posiciona el generador medialmente hasta la apófisis xifoides donde se fija y posteriormente, se tuneliza en forma cefálica (a 1 a 2 centímetros a la izquierda y paralela al esternón), tratando de colocar la punta distal del catéter cerca de del manubrio esternal. Este catéter subcutáneo consta a lo largo de su recorrido paralelo al esternón de dos electrodos (uno proximal y otro distal) con capacidad de sensado. Entre los 2 electrodos de sensado se extiende el coil de desfibrilación que junto a al generador cierran el circuito de desfibrilación (carcaza activa).
Los sitios de inserción de los electrodos y el generador se evaluaron exhaustivamente tanto en animales como humanos para optimizar la capacidad de sensado y desfibrilación del dispositivo. 3 Es importante destacar que no debe quedar aire en la cavidad que aloja la carcaza porque el atrapamiento aéreo a este nivel ha sido causa de demoras en la desfibrilación o de choques inapropiados por ruido. Asimismo, el catéter paraesternal debe quedar posicionado lo más cerca posible de la superficie ósea, sin mucha interposición grasa por el mismo motivo. 4
Un detalle no menor es que el implante se realiza todo en base a parámetros anatómicos y no requiere el uso de fluoroscopia. El implante puede hacerse con 2 o 3 incisiones de acuerdo a la contextura física del paciente. Se deben realizar siempre la incisión torácica lateral izquierda para albergar el generador y la del apéndice xifoides para tunelizar el cable hasta allí y fijarlo. La aproximación cefálica al manubrio esternal puede hacerse sin incisión o con una tercera incisión a ese nivel para fijarlo por segunda vez y que el catéter no se desplace hacia los lados. Este abordaje se recomienda en pacientes obesos o mujeres con mamas grandes. En cuanto a eficacia de la colocación, ambos abordajes fueron similares pero al elegir uno u otro, hay que considerar que la incisión superior es la más dolorosa para el paciente en el postoperatorio y la más expuesta a infecciones por lo que se debe evitar siempre que se pueda. Por otro lado, en pacientes con corazones más horizontales se prefiere la posición paraesternal derecha del catéter para incluir más masa miocárdica en el circuito de desfibrilación.5
El dispositivo consta de una programación de sensado en zonas con función de discriminación de arritmias y de elección de terapia. Consta de una zona de choque en la cual detecta FV analizando solamente frecuencia y duración; las primeras versiones del dispositivo estaban limitados una programación de “zona única” de choque con un corte de frecuencia relativamente bajo (180 lpm). En las siguientes generaciones del CDI-S se logró la programación de una zona condicional: esta opera dentro de un rango de frecuencia definida por el operador que será menor a la zona de choque y tiene la capacidad de analizar morfología discriminando TSV de TV, esta cualidad, como ahondaremos más adelante, permite evitar choques inapropiados por taquiarritmias supraventriculares (Ver Figura Nº 6). La zona condicional tiene función además de comparar la morfología de cada latido logrando determinar si se encuentra frente a un ritmo polimorfo.6
Como veremos en el apartado de limitaciones, el CDI-S no provee terapia antitaquicardia ni marcapaseo aunque puede generar un marcapaseo transtorácico temporal post choque en caso de una asistolia como ya mencionamos.
El dispositivo tiene capacidad de monitoreo remoto, y se evidenció en estudios pequeños de cohorte que podría ser resonable (los de tercera generación lo son) y tiene la capacidad de detectar fibrilación auricular .7
- Test de desfibrilación post implante
Un aspecto importante destacar en cuanto al uso clínico del CDI-S es que aunque la realización del test de desfibrilación intraoperatorio de rutina fue puesto en discusión en los CDI-TV, si parece particularmente importante su realización en los subcutáneos. (Ver Figura Nº 4) 8
Un estudio retrospectivo analizó 102 pacientes que se colocaron un CDI-S (50 pacientes (p) por prevención primaria y 52 por prevención secundaria, con una edad media de 41 años) a los que se les realizó el test de desfibrilación durante el implante. En 74 p (75%; IC 95% 0.66–0.83) la fibrilación ventricular (FV) inducida fue efectivamente rescatada por el equipo. En 24 (25%; IC 95% 0.22–0.44) el primer choque no fue efectivo y requirieron choques externos. En estos casos la desfibrilación efectiva se logró cambiando la polaridad del shock, optimizando el vector proveniente del generador o con el reposicionamiento del catéter.8
En otro estudio realizado en Francia en el año 2018, se evaluaron 137 pacientes a los que se les realizó inducción de TV/FV una vez finalizado el implante del CDI-S. La edad media era de 48 años, 52% con cardiomiopatía isquémica, la fracción de eyección (Fey) promedio fue de 47% y el 56% tenía indicación de CDI por prevención primaria. En cuanto a los resultados de la inducción se observó que solo el 29% tuvo una detección optima (grupo 1) , 51% tuvo un subsensado de FV con prolongación moderada del tiempo a la terapia (<18 segundos (seg)) (grupo2) , un 14% tuvo subsensado de FV con prolongación significativa del tiempo a la terapia (>18 segundos) (grupo 3) y solo un 6% ausencia de terapia o prolongación de tiempo a terapia secundarias a sobresensado de ruido con requerimiento en el primer grupo de desfibrilación externa (grupo 4). El origen del “ruido” se interpretó como actividad muscular diafragmática anormal (espasmo) secundaria a la inducción de la arritmia, por lo que en teoría no representaría un problema con las arritmias espontáneas. En estos pacientes se ajustó el vector de sensado evidenciándose en la segunda inducción, una detección apropiada. No se evidenciaron diferencias entre los distintos grupos en cuanto a edad, sexo, Fey o vector de sensado elegido; si se evidenció una diferencia estadísticamente significativa en cuanto la frecuencia de corte programada para la zona de choque que fue mayor en el grupo 3 (grupo 1: 191+/-26 lpm; grupo 2: 199+/-27 lpm; grupo 3: 216+/-22 lpm; grupo 4: 210+/-28 lpm; p <0.01 entre todos los grupos y p<0.01 entre grupos 1 y 3). En base a esto se puede plantear que la programación de una frecuencia de corte menor para la zona de choque se asocia a una mejor calidad de sensado durante un episodio de FV/TV, pero esto se podría asociar a un mayor riesgo de terapias inapropiadas. Los autores reafirman en base a estos hallazgos la necesidad de realizar de forma sistemática un test de desfibrilación al momento de la colocación del CDI-S que a su vez permita ajustar el sensado y la programación en zonas.6
Se evidenció a su vez en este estudio un tiempo promedio entre la inducción de la arritmia y la descarga, de 16 segundos, lo que es considerablemente mayor que el tiempo de descarga de los CDI-TV; destacan los autores además en este aspecto que la energía de choque en este estudio fue de 65J y el tiempo de carga en caso de una arritmia espontanea puede ser aún mayor ya que la energía aportada por el equipo es de hasta 80J. Se notó a su vez una variabilidad considerable en el tiempo a descarga entre paciente y paciente que es mucho mayor a la de los dispositivos intracavitarios. Los autores proponen como opciones para la optimización de estos aspecto reforzar el screening pre implante (ver “Detección”) de forma sistemática para determinar el vector de sensado más óptimo; el ajuste de las frecuencias de corte para la zona de choque como mencionamos previamente; el ajuste de la zona condicional que se suele asociar a una menor sensibilidad (y a una menor tasa de terapias inapropiadas); y en un futuro ajustes del algoritmo de sensado que permitan mejorar la sensibilidad sin alterar su especificidad.6
En este contexto se realizó un trabajo publicado este año (2019) que tuvo como objetivo evaluar el tiempo terapia en el CDI-S en una población mayor, determinar el impacto del mismo en la reversión de la FV y a la vez tratar de determinar posibles predictores de un posible retraso. Se analizaron pacientes a los que se les colocó un CDI-S y se les realizó un test de desfibrilación con 65J en 53 centros italianos. Se evaluaron en total 570 pacientes, 82% hombres, edad media 48 años con Fey promedio de 47%. La desfibrilación fue exitosa en el 97,7% de los pacientes; en 12 pacientes el choque no revirtió la FV y en un paciente el choque no se produjo por ruido proveniente de atrapamiento aéreo. Todas las fallas fueron exitosamente manejadas con reprogramación y reposicionamiento del dispositivo. El tiempo medio a terapia fue de 15 segundos y fue mayor a 18 segundos en 9% de los pacientes. Los predictores independientes de retraso de terapia (>18s) fueron la fracción de eyección (OR, 0.98; IC 95%, 0.96-0.99; p=0.016) y la ganancia del sensado programada al doble (OR, 3.66; IC 95%, 1.44-9.30; p=0.006). El choque con 65J no afecto la efectividad y no se asoció con un retraso en el tiempo a terapia si bien no fue estadísticamente significativo (OR, 1.13; IC 95% , 0.97-1.32; p=0.122). Los autores de este estudio concluyen que en el análisis de una población de mayor número de pacientes, el retraso del tiempo a la terapia ocurrió menos frecuentemente que lo reportado en estudios previos y en los casos en los que se evidenció un retraso este no tuvo efecto en la conversión de la FV. 9
3.2) Detección. Terapias inapropiadas.
Como dijimos previamente, el dispositivo dispone de dos electrodos uno proximal y uno distal ubicados en un único catéter que se ubica idealmente en la región paraesternal izquierda y un generador, todos ellos con capacidad de sensado. Así quedan configurados automáticamente 3 vectores de sensado: primario (electrodo proximal-carcaza), secundario (electrodo distal-carcaza) y alternativo (electrodo proximal- electrodo distal) (Ver Figura Nº 1).
El screening pre-implante utilizando electrodos de superficie previo a la colocación del dispositivo es un elemento crucial para la aplicación clínica del mismo. El CDI-S consta de un software con capacidad de discriminación de ondas (P, QRS,T). El screening pre-implante permite identificar individuos en los cuales dicha discriminación no es posible. Una vez implantado el dispositivo determinará automáticamente el vector más óptimo de acuerdo a la amplitud de la onda R sensada y del más satisfactorio cociente onda R/ Onda T para minimizar el riesgo de doble conteo y sobresensado de T. Asimismo la polaridad de sensado puede ser modificada de forma manual por el operador. Se recomienda hacer el screening en 2 posiciones para asegurarse de un adecuado sensado porque en las primeras generaciones de dispositivos era un motivo de demora en la terapia. Solo 1 de los 3 vectores que sea óptimo en las 2 posiciones es suficiente para que el paciente sea elegible. Es importante recalcar que la capacidad de discriminación puede verse afectada por factores tales como dilatación auricular, isquemia, bloqueos de rama, variaciones anatómicas y postura.10 Estas limitaciones que se encontraban la primera generación de dispositivos, fueron mejoradas en la 2da y 3ra generación.
Debido al alto riesgo de choques inapropiados por sobresensado de onda T aquellos pacientes que fallen el screening no serán elegibles para la colocación de un CDI-S. Se realizaron distintos trabajos en los que se evaluó la elegibilidad para CDI-S basándose en screening previo demostrándose que 7 a 10% fallan, con una tendencia a mayor de inelegibilidad en pacientes con miocardiopatía hipertrófica o enfermedades congénitas. Tanto el screening en reposo como durante el ejercicio fueron descriptos para evitar el sobresensado de la onda T.3 Un estudio realizado por Kooiman, et al evaluó la prevalencia de choques inapropiados del CDI-S en 69 pacientes, con una edad media de 39, 73% implantado por prevención primaria, 41% por un síndrome genético proarrítmico y 15% presentaba cardiopatía isquémica. En el seguimiento, 10 pacientes (15%) recibieron choques inapropiados a los 8.9 +/- 10 meses del implante (10,8% tasa de incidencia anual), 8 de los choques inapropiados fueron secundarios a sobresensado de la onda T y 7 de ellos ocurrieron durante el ejercicio. Esto llevó a los investigadores a evaluar a todos los pacientes que sufrieron choques inapropiados por ese motivo con un test de ejercicio durante el cual se determinó el vector más efectivo para el sensado; luego de la optimización no volvieron a presentar eventos en un año de seguimiento. En este estudio se propuso el screening con test de ejercicio en pacientes con alto riesgo de sobresensado de onda T (bloqueo rama derecha, uso de digoxina o trastornos de la repolarización).11
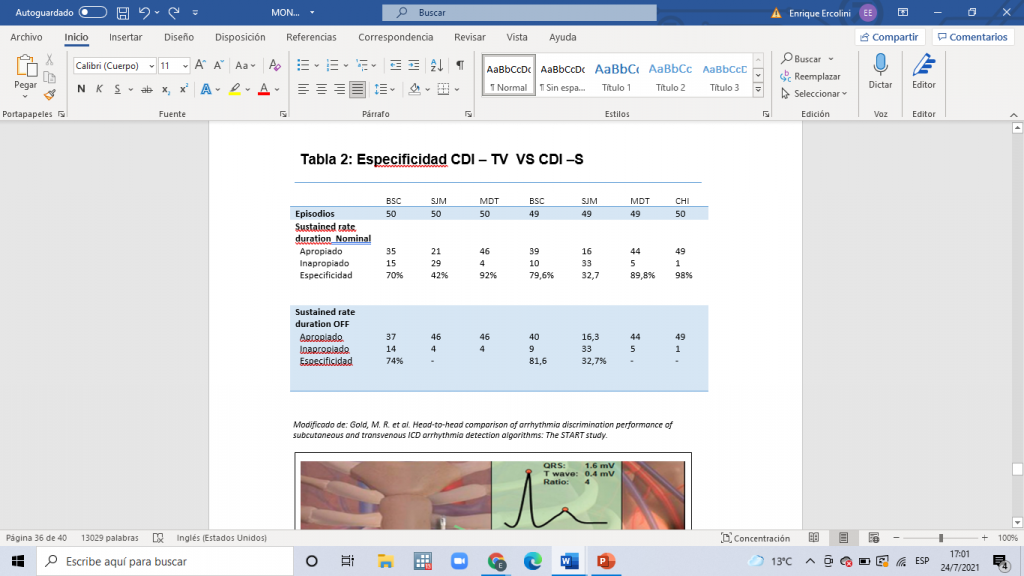
El START fue un estudio multicéntrico, prospectivo que tuvo como objetivo evaluar la capacidad de discriminación de arritmias del CDI-S con respecto al CDI-TV. Se incluyeron 64 pacientes que tenían colocado un CDI bicameral o un resincronizador cardiaco a los cuales se les indujo arritmias ventriculares y supraventriculares, colocando en ellos tres electrodos de superficie simulando el sistema de sensado del CDI-S; de esta manera se logró el análisis del sensado de arritmias idénticas en ambos dispositivos de forma simultánea. La edad promedio fue de 60 años, 50% presentaba cardiopatía isquémica con una Fey media de 30%, 80% tenían indicación de CDI por prevención primaria y 20% por prevención secundaria; se excluyeron los pacientes con FA permanente o persistente.10
Es importante destacar que se estudió exclusivamente la capacidad de discriminación de arritmias sin tener en cuenta la eficacia terapéutica. Todas las taquicardias ventriculares fueron detectadas utilizando una configuración de sensado de zona única obteniéndose una sensibilidad del 100% para ambos dispositivos. En cuanto a la configuración en dos zonas la sensibilidad del CDI-S se mantuvo en 100% respecto al 99,3% de la cohorte de CDI-TV unicamerales. En cuanto a la detección de arritmias auriculares el CDI-S registró una especificidad del 98% fallando en detectar 1 de 50 arritmias auriculares inducidas, mientras que el CDI-TV presentó una especificidad del 68% obteniéndose en este aspecto una diferencia significativa entre ambos dispositivos (P<0,001) (Ver Tabla Nº 2). Se debe tener en cuenta, como se mencionó previamente, que las arritmias en este estudio no fueron espontáneas sino inducidas, y además que se simuló el sistema de sensado del CDI-S utilizando electrodos de superficie pudiendo existir diferencias entre ambos sistemas (aunque estudios previos demostraron que la extrapolación con electrodos de superficie debería ser confiable). Por último, se debe destacar que en este estudio la principal arritmia supraventricular inducida fue la FA, que aunque suele ser la principal causa de terapias inapropiadas, el análisis de otras arritmias pudo haber arrojado resultados distintos. Más allá de estas limitaciones, se concluye que ambos sistemas tienen una adecuada capacidad de detección de taquicardias ventriculares con una sensibilidad cercana al 100% pero existe entre ellos una marcada diferencia en cuanto a la detección de taquicardias auriculares a favor del CDI-S en relación a los CDI-TV ya sean uni o bi-camerales.10
El EFFORTLESS (Boston Scientific Post Market S-ICD registry) y el IDE (S-ICD System IDE Clinical Investigation) son dos estudios de cohorte prospectivos que evaluaron la experiencia con el CDI-S a nivel mundial cuyo objetivo fue determinar la eficacia y seguridad del mismo. Ambos comenzaron la recopilación de datos a partir del 2009 un año posterior a los primeros estudios piloto de CDI-S en humanos. Los resultados reportados de forma separada de ambos estudios determinaron efectivamente la seguridad y eficacia del dispositivo.12 Como la tasa de eventos adversos en cada estudio por separado eran bajas, se los unió para lograr una población de mayor número de pacientes y con un seguimiento mayor que lograra más representatividad del CDI-S en el mundo real. Los diseños y los puntos finales de ambos estudios son similares, lo que posibilitó su análisis conjunto.
La cohorte combinada de ambos estudios incluyó 882 pacientes (568p del EFFORTLESS, 308p del IDE y 13p de ambos, 7 fueron excluidos porque no fue efectiva la desfibrilación y fueron sacados del IDE) y se evaluó incidencia de complicaciones, choques apropiados e inapropiados, eficacia de desfibrilación y mortalidad. La población consistió mayormente en hombres jóvenes con una mejor fracción de eyección en comparación con otros estudios prospectivos de CDI-TV. Casi el 70% de la población tenia indicación por prevención primaria y los pacientes que recibieron el dispositivo por prevención secundaria, que fueron la minoría, el 75% presentó FV o TV polimorfa (Ver Tabla Nº 1).12
Se realizó un seguimiento de 882 pacientes a los que se les colocó un CDI-S por 651+/-345 días. En lo que respecta a la programación quedó a criterio del médico tratante y se evaluaron programaciones en una y dos zonas (zona condicional), siendo la segunda la más elegida. Se evidenció a lo largo del enrolamiento en el periodo de tiempo estudiado un aumento significativo en la utilización de la programación en dos zonas de 51% a 95% (p < 0.01). El corte de frecuencia para la zona de detección de FV también quedó a criterio del operador y la media de la zona de choque con menor corte fue de 200 lpm. Se evidenció que en pacientes con programación en dos zonas tuvieron una incidencia de choques inapropiados a los 3 años de 11.7% en comparación con 20,5% en los CDI-S programados en una zona. Las principales causas de choques inapropiados fueron las arritmias supraventriculares por sobre la zona de discriminación (24%), error de discriminación de arritmias supraventriculares (1%), sobresensado de onda T (39%), baja amplitud de señal (21%), y sensado de señales no cardíacas (8%). La incidencia de choques inapropiados en este análisis combinado fue mayor a la evidenciada en el estudio EFORTLESS a expensas del estudio IDE que se considera el representativo de la experiencia inicial con el CDI-S. Globalmente se evidenció que la incidencia de choques inapropiados cayó un 34% comparando el primer quartilo de pacientes enrolados con el cuarto quartilo (Ver Figura Nº 7). Los autores atribuyen esta disminución significativa de choques inapropiados a la mejoría de los métodos de screening pre-implante, la experiencia brindada por estudios como el START, MADIT-RIT (que demostró que la programación con zonas de frecuencia altas (200 lpm) y la prolongación del tiempo de detección y el retraso en las terapias en zonas intermedias (170 lpm) disminuyo los choques inapropiados y la mortalidad en una cohorte de pacientes con CDI TV, situación equiparable a la programación en 2 zonas del CDI-S13) y los primeros reportes de este estudio combinado que llevaron a la cada vez más utilizada programación en dos zonas y frecuencias de corte mayores (Ver Figura Nº 6). 12
En el 2018 se publicó un Propensity Score comparando los resultados obtenidos con CDI-TV versus CDI-S en los trabajos SIMPLE y EFFORTLESS respectivamente (n=798 CDI-SC). El estudio SIMPLE fue un estudio que evaluó la eficacia y seguridad del CDI-TV discriminando según dispositivos unicamerales (n=1091) y bicamerales (n=553)14. Se realizó una curva de Kaplan-Meier para evaluar complicaciones en las que se requirió una intervención invasiva, choques apropiados y choques inapropiados por un periodo de 3 años. La población estudiada presentó una edad promedio de 55 años, 49% presentó cardiopatía isquémica, Fey media 40%, 71% con indicación por prevención primaria y el 89% de los CDI-TV fueron unicamerales. En este estudio se evidenció una incidencia menor de choques inapropiados en el grupo con CDI-TV vs CDI-S que no obtuvo significación estadística: 7.9% (95% IC 5.6–11.1%) Vs 11,9% (95% IC 8.8–15.9%) p=0.07. La mayoría (77%) de los choques inapropiados en CDI-TV fueron secundarios a taquicardias supraventriculares en comparación con un 17% en pacientes con CDI-S. La mayoría de los choques inapropiados del CDI-S fueron secundarios a sobresensado (19% de señales extra-cardíacas). Se evidenció además en este estudio que la carga de choques en la cohorte con CDI-SC fue de 20% respecto al 31% observado en pacientes con CDI-TV. (p=0,05).15 Se debe tener en cuenta que una de las limitaciones del estudio SIMPLE radica en el hecho de que no se exigía uniformidad en la programación, lo cual es fundamental a la hora de comparar choques apropiados e inapropiados.15
3.3) Eficacia y seguridad
Como hicimos referencia previamente el EFFORTLESS y el IDE son dos estudios de cohorte prospectivos que evaluaron la experiencia con el CDI-S a nivel mundial cuyo objetivo fue determinar la eficacia y seguridad del mismo.12
En cuanto a la evaluación de la eficacia del dispositivo se registraron a lo largo del seguimiento en ambos estudios 111 eventos de VT/FV tratados, el 90,1% fueron terminados con un choque y 98,2% fueron terminados dentro de los 5 choques disponibles, estos porcentajes son comparables a los observados con el CDI-TV. Solo hubo dos episodios de VT/FV polimorfos no convertidos, de los cuales uno revirtió espontáneamente después del quinto choque y en el segundo episodio el dispositivo declaró prematuramente el fin del episodio por presentar subsensado después de dos choques; un nuevo evento fue inmediatamente reiniciado y fue terminado con un choque. Se registraron 12 tormentas eléctricas de FV/TV en 7 pacientes, 10 de ellas fueron convertidas exitosamente, una presentó múltiples episodios de TV cada uno exitosamente revertido por el CDI-S hasta que el evento fue finalizado por un desfibrilador externo una vez en el hospital; el otro evento reportado fue en un paciente con síndrome de Loeffer que presentó una de falla de conversión de una FV terminal. En el periodo de seguimiento solo en un paciente se decidió cambiar el dispositivo por uno con capacidad de ATP en base a la carga de choques que presentaba porTV monomorfa sostenida. El tiempo a terapia promedio para todos los eventos fue de 19.2 segundos +/-5.3seg (TVM: 18,2seg; TVP y FV: 20,5seg). La mortalidad de todas las causas fue de 2,9% con solo un evento arrítmico mortal mencionado previamente (0,1%). Los autores de este estudio concluyen en base a estos resultados que el CDI-S es un dispositivo eficaz para la detección y cardioversión de arritmias espontáneas en comparación con la eficacia de los CDI-TV. Estos dos estudios excluyeron los pacientes que se podrían beneficiar de ATP, y sus resultados mostraron que la selección de pacientes fue adecuada con solo un paciente en el que se decidió un cambio de dispositivo. También destacan la disminución de choques apropiados a lo largo de los años en relación a la programación en dos zonas y la programación de frecuencias de corte más altas para iniciar una descarga. Notan en base a esta última observación la importancia de no tratar eventos autolimitados siendo esto tan relevante como la conversión exitosa de FV/TV ya que los 125 episodios de FV/TV que se autolimitaron sin reportes asociados de síncope o mortalidad hablan de la eficacia de la prolongación deliberada del tiempo a terapia gracias a los nuevos algoritmos de sensado y estrategias de programación.12
En el Propensity Score mencionado previamente que comparólos resultados obtenidos con CDI-TV versus CDI-S en los trabajos SIMPLE y EFFORTLESS respectivamente, evidenció de forma significativa, una menor tasa de choques apropiados en pacientes con CDI-S, 9.9% (95% CI 7.0– 13.9%), en comparación con el grupo CDI-TV, 13.8% (95% CI 10.8–17.8%), P=0.03. Como se mencionó previamente una de las mayores limitaciones del Propensity Score radica en el hecho de que en el estudio SIMPLE no se discriminó la eficacia del CDI-TV teniendo en cuenta la programación. 15
Un ensayo realizado en Holanda que incluyo 1111 p, comparó CDI-S vs CDI-TV en cuanto a complicaciones, descargas inapropiadas y apropiadas a 5 años y evidenció en este último aspecto una mayor tasa de descargas apropiadas en el grupo con CDI-TV una vez ajustado a zonas de programación (HR 2.42; P=0.01). Esta diferencia, según los autores, podría ser explicada porque el CDI-S tiene un mayor tiempo de carga por lo que permitiría que las TV no sostenidas finalicen antes de la descarga.16
En Agosto de este año se publicó un nuevo meta-análisis que incluyó 7820 pacientes en 10 estudios longitudinales-observacionales publicados entre el 2013 y 2018 que evaluó la efectividad y seguridad del CDI-S respecto al CDI-TV. El 70% de los pacientes eran hombres, el rango de edad fue de 20 a 56 años, Fey media de 42,% y 41% en CDI-S y TV respectivamente, las causas más frecuentes de indicación de CDI fueron la miocardiopatía isqúemica y la miocardiopatía hipertrófica. Como resultados principales observaron: 1) Calidad de vida asociada a la salud sin diferencias significativas (Salud física: Mean difference=2.90; 95% IC=-3.88, 9.68 / Salud mental: Mean difference=0.13; 95% IC=-2.11-2.37); 2) Mortalidad CDI-S 4,4% vs CDI-TV 5,9% (OR=0.79; 95% CI=0.50-1.24); 3) Sin diferencias significativas en efectividad de conversión de arritmias en el primer choque (OR=0.71; 95% IC: 0.43-1.18); 4) Sin diferencias significativas en cuanto a infecciones (OR=1.79; 95% IC=0.93-3.43); 5) Sin diferencias significativas en cuanto a choques inapropiados (OR=1.28, 95% IC=0.91-1.78), la principal causa en CDI-S fue el sobresensado (particularmente de la onda T) y TSV en CDI-TV; 6) Reducción significativa de complicaciones asociadas a electrodos/catéter en pacientes con CDI-S (OR=0.13, 95% IC=0.05-0.29) y menor movimiento de los electrodos/catéter con el CDI-TV; 6) Menor incidencia de neumotórax en CDI-S vs CDI-TV (OR=0.17; 95% CI=0.03, p=0.97). Se evidenció a su vez una mayor tasa de choques apropiados en el grupo con CDI-TV interpretada como secundaria a las características basales de la población o potencialmente a efectos pro inflamatorios del cable endocavitario.17
Se realizó a su vez un estudio multicéntrico prospectivo que valoró la experiencia del CDI-S en Argentina. Se evaluaron pacientes a los que se les colocó un CDI-S desde julio de 2017 a Febrero de 2019. Se incluyeron 27 pacientes, 78% varones, edad promedio 32 años con indicación por prevención primaria en 74% de los pacientes, 48% con diagnóstico de miocardiopatía hipertrófica. Todos los pacientes pasaron exitosamente el screening. En 25 se indujo FV, lográndose reversión en la primera descarga en 24 pacientes y uno requirió dos descargas. El sensado fue adecuado en todos los casos y se registró un tiempo promedio a la descarga de 16,99 segundos (rango 11,2-23,2seg). Solo se constató un episodio de terapia inapropiada que se resolvió con reprogramación del sensado y un caso de infección de bolsillo que resolvió con tratamiento antibiótico convencional.18
3.4) Complicaciones.
El pasaje del catéter ventricular a través de la válvula tricúspide genera fricción sobre el mismo, sin contar los problemas que el catéter en si puede generar en las valvas en caso de perforarlas, generando además disfunción valvular. Otra área de stress mecánico para el catéter son los movimientos el hombro, por su proximidad a la articulación escapulo humeral en caso de ser colocado por vía axilar o cefálica. La vía subclavia tiene la dificultad adicional de que si la punción es muy distal el catéter puede quedar en la unión de la clavícula y la primera costilla, generando fricción permanente y un posible deterioro a largo plazo. (“crush syndrome”).
Las fallas del marcapasos se estiman alrededor del 40% a los 5 años variando ampliamente según el diseño del catéter3. Son frecuentes además las complicaciones médicas secundarias a las cualidades trombogénicas del cable intravascular y las infecciones asociadas a dispositivo que pueden requerir extracción del sistema, y por encontrarse el catéter en el compartimento intravascular las mismas pueden generar bacteriemia y endocarditis. Se presenta la complicación adicional que en caso de requerirse la extracción del dispositivo es frecuente la trombosis, fibrosis y adherencia del catéter por lo que la extracción suele ser dificultosa con riesgo de rotura venosa o perforación cardíaca, disfunción valvular, hemotórax y muerte. Otra consideración a tener en cuenta es que la fricción constante contra el anillo tricuspídeo puede generar dilatación del mismo e insuficiencia tricuspídea secundaria3.
Como mencionamos previamente en los estudios prospectivos EFFORTLESS e IDE se realizó una evaluación sistemática del tipo y la incidencia de complicaciones asociadas al CDI-S. Se evidenció en el análisis combinado que el 4,5% de los pacientes presentaron complicaciones dentro de los 30 días y 11,1% presentaron complicaciones dentro de los 3 años, valores mucho más bajos que el CDI TV (Ver Figura Nº 5). EL 40% de todas las complicaciones ocurrieron dentro de los primeros 30 días. La infección y la ubicación subóptima del electrodo o del generador fueron las complicaciones más frecuentes, todas ellas sucedidas durante el implante o los primeros 7 días posteriores. La ubicación subóptima del electrodo o del generador fue resuelta con posterior revisión del mismo. La depleción prematura de la batería o la incapacidad de comunicarse con el programador fueron infrecuentes (0,6 y 0,3%) y no se evidenciaron fallas de los electrodos ni bacteriemia asociada al CDI-S a lo largo del seguimiento. La extracción del CDI-S para cambio de dispositivo fue necesaria en 4 pacientes (0,4%) por requerimiento de terapia antitaquicardia, marcapaseo ventricular o requerimiento de resincronización ventricular. Se evidenció en primera instancia una diferencia en la tasa de complicaciones entre ambos estudios pero cuando se ajustó por momento de enrolamiento de los pacientes se evidenció que esta diferencia es no significativa. Como conclusión en este aspecto los autores notan que la complicación más frecuente fue la infección no asociada a bacteriemia que requirió intervención directa, particularmente durante la experiencia inicial con el CDI-S. En base a esto se tomaron medidas como la optimización de las técnicas quirúrgicas para reducir el área de incisión, el manejo agresivo de las infecciones para evitar la extracción del dispositivo, además de la mayor experiencia de los operadores; todo lo cual llevó a una disminución de las tasas de infección. La simplicidad del implante sin necesidad de un acceso vascular se reflejó en muy bajas tasas (2%) de complicaciones agudas mayores (hematomas, mal posicionamiento del cable o dispositivo y neumotórax).12
Como mencionamos previamente en el 2018 se publicó el Propensity Score comparando los resultados obtenidos con CDI-TV Vs CDI-S en los trabajos SIMPLE y EFFORTLESS respecto de las complicaciones:
- Las asociadas al catéter fueron de 0,3% vs 2,3% (p=0,03) a favor del CDI-S. Se observó una incidencia de complicaciones con requerimiento de intervención invasiva de 9% para el CDI-S en comparación de 6,5% en CDI-TV a los 3 años de seguimiento (p 0,03). La infección asociada a dispositivo con requerimiento de reintervención se observó en 2,6% de los pacientes con CDI-S vs 0,5% en pacientes con CDI-TV (p=0,09); ninguna de estas infecciones resultó en endocarditis infecciosa.
- Las asociadas al generador de pulso (erosión, hematoma, movimiento del generador de pulso, seroma del bolsillo) se evidenciaron en 3,8% de los pacientes con CDI-S Vs 1,8% en pacientes con CDI-TV no habiendo diferencias significativas en este aspecto (p= 0,14).
- La tasa de mortalidad fue no significativamente menor en la cohorte de CDI-S, HR 0,74 (95% IC 0.41–1.35; P=0.32). La tasa de supervivencia a los 3 años fue de 93,7%.
Los autores de este estudio concluyen que las complicaciones asociadas a dispositivo son de baja incidencia y similares en ambos grupos, teniendo en cuenta que el estudio evaluó principalmente CDI-TV unicamerales de los cuales se esperaría la menor tasa de complicaciones. Se observó de todas maneras una diferencia significativa de complicaciones asociadas a catéter a favor del CDI-S, considerando además que el seguimiento fue solo de 3 años por lo que esta diferencia podría estar subestimada. La diferencia entre complicaciones infecciosas demostró ser no significativa en este estudio entre ambos grupos; si se evidenció una mayor tasa de complicaciones asociadas al bolsillo en la cohorte de CDI-S que puede tener que ver con la poca experiencia del operador en la experiencia inicial con el CDI-S. Como limitaciones el estudio remarca la necesidad de un seguimiento prolongado teniendo en cuenta que las complicaciones asociadas a catéter intracavitario son más frecuentes entre los 5 y 10 años post implante.15
El estudio citado previamente realizado en Holanda, también evaluó la incidencia de complicaciones a largo plazo (5 años) entre ambos dispositivos. La tasa de complicaciones global a los 5 años fue de 13.7% (95% IC: 6.4%-20.3%) para el grupo con CDI-S vs. 18% (95% IC 10.5%-24.8%) para el grupo con CDI-TV (p=0,8). Las complicaciones asociadas a catéter fueron menores con el CDI-S respecto al CDI-TV (0,8% VS 11,5% respectivamente; p=0.03). A su vez, las que requirieron intervención quirúrgica fueron más frecuentes en el grupo con CDI-TV (11.5%; 95% IC: 5.3% a 17.2%) respecto al grupo con CDI-S (0.8%; 95% CI: 0.0%-2.2% p=0,03). Por otro lado las infecciones fueron más frecuentes en el CDI-S (4.1%; 95% IC: 0.5%-7.7% vs.3.6%; 95% CI: 0.0%-7.1%) P=0,36. Se evidenció a su vez una mayor tasa de complicaciones no asociadas a catéter (erosión de bolsillo, falla del dispositivo) con el CDI-S (9,9% vs. 2.2%, p 0.47) En base a estos resultados los autores señalan que las tasas de complicaciones son similares pero de distinta naturaleza, identificando como ya hemos visto el catéter intracavitario como el punto débil del CDI-TV.16
3.5) Selección de pacientes.
El CDI-S, como mencionamos previamente no cuenta con función de marcapasos, por lo que pacientes con que requerimiento de marcapaseo debido a enfermedad del nodo sinusal o auriculoventricular no deberían ser considerados para CDI-S. Sin embargo si el paciente no requiere marcapasos al momento del implante del CDI-S la probabilidad de requerirlo en el futuro es baja. En caso de que el paciente requiera un marcapasos en el futuro, como ahondaremos más adelante, se podría asociar el CDI-S ya implantado con un marcapasos TV o incluso sin cables.
Pacientes con asincronía ventricular significativa asociados a BCRI (QRS 150 milisegundos), Fey 35% o menos con síntomas en CF NYHA II-III se beneficiarían con un resincronizador cardiaco más que con un CDI-S.
Otro reto en cuanto a la selección de pacientes es definir quienes se beneficiarían de la ATP por lo que tendrían indicación de CDI-TV, pero como mencionamos previamente hay estudios que evidenciaron que la programación de un tiempo de detección prolongado o el uso de zonas de descarga con zonas de corte altas (pensando en las taquicardias que se autolimitan) evitarían los choques innecesarios con la misma efectividad que la terapia antitaquicardizante. 3
Es importante destacar que la indicación de CDI-S desde el comienzo de su aplicación tendió a realizarse en pacientes con antecedentes de infecciones asociadas a catéter, prevención secundaria o pacientes con shunts sistémicos pulmonares con mayor riesgo de eventos tromboembólicos asociados a catéter. Sin embargo, es probable que la población con indicación de CDI por prevención primaria sea la que más se beneficie del CDI-S. Aunque es reconocido que el CDI en prevención primaria salva vidas, lo cierto es una gran proporción de pacientes nunca sufre un evento. Hasta que no mejore la estratificación de riesgo se podría argumentar que esta población estaría expuesta a menor daño potencial con un CDI-S en la ausencia de un beneficio claro del CDI en sí. 3
Los pacientes jóvenes son una población que se beneficiaría particularmente de un CDI-S teniendo en cuenta la mayor probabilidad de complicaciones asociadas a catéter a lo largo de la vida y teniendo en cuenta que llevan adelante un estilo de vida más activo lo que podría asociarse a una mayor tasa de dichas complicaciones. El estudio realizado por M.Bettin et al, tuvo como objetivo evaluar el uso de CDI-S específicamente en una población joven. Se incluyeron 31 pacientes menores a 26 años, 13 de ellos menores de 20 años, a los que se les colocó un CDI-S entre Julio del 2010 y diciembre del 2016 y se los comparó con un grupo control de la misma edad con CDI-TV; todos los CDI-S fueron programados con una zona condicional. De los 31, 13 (41,9%) tenían indicación de CDI-S por prevención primaria, 60% con trastornos eléctricos de base (Sme QT prolongado, Sme Brugada, TV catecolaminérgica…) o FV idiopática. Las arritmias ventriculares fueron adecuadamente terminadas en 8 pacientes (25,8%) y la tasa de choques inapropiados fue del 16% sin diferencias significativas con el grupo control en cuanto a choques apropiados o inapropiados. Se determinó que la edad temprana es un predictor independiente de choques inapropiados del CDI-S. (hazard ratio: 0.56; 95% IC: 0.34 to 0.92; p < 0.05). Los autores de este estudio concluyen que el CDI-S podría ser una alternativa segura y efectiva para prevención MS en la población joven. 19
Otro estudio realizado por Boris Rudic et al tuvo como objetivo evaluar la eficacia en pacientes con síndromes arrítmicos hereditarios. Se evaluaron 62 pacientes enrolados entre 2010 y 2016 sin indicación de terapia antibradicardia, el seguimiento fue de 31 +/-14 meses y se incluyeron 24 pacientes con síndrome de brugada, 17 con FV idiopática, 6 con síndrome QT prolongado, 1 con síndrome QT corto, 3 con síndrome TV polimórfica catecolaminérgica y 3 con miocardiopatía arritmogénica del VD. Un 62% de los pacientes tenían indicación de CDI por prevención secundaria. En el seguimiento, se constataron 20 taquiarritmias con requerimiento de descarga en 10 pacientes, todos los episodios fueron terminados con una única descarga de 80J. Dos pacientes sufrieron descargas inapropiadas secundarias a sobresensado y no se constataron infecciones de bolsillo. Aún teniendo en cuenta que no se contó con un grupo control de pacientes con CDI-TV y que es posible la progresión de los trastornos de conducción más allá del tiempo de seguimiento, los autores consideran que el CDI-S es una alternativa terapéutica segura y efectiva para prevención de arritmias malignas el pacientes con canalopatías. 20
La miocardiopatía hipertrófica (MCPH) es la miocardiopatía más frecuente con una incidencia de 1/500 y se asoció en una minoría de casos a muerte súbita. Los pacientes con mayor riesgo pueden ser discriminados por métodos no invasivos con colocación de CDI por prevención primaria. La problemática con estos pacientes en este aspecto radica en la alta tasa de TSV que puede llevar a un mayor riesgo de choques inapropiados.. Por otro lado la función de sensado del CDI puede verse afectada por particularidades de estos pacientes como la hipertrofia del VI y las anormalidades en el ECG que pueden llevar a sobresensado onda T. Se realizó un subanálisis del estudio EFORTLES-IDE que analizó específicamente a los pacientes con MCPH. En esta cohorte se incluyeron 99 pacientes con MCPH y 773 pacientes sin MCPH con un seguimiento medio de 637 días. La cohorte de pacientes con MCPH fue más joven y con mayor tendencia a la indicación CDI-S por prevención primaria (88.5% vs 67.5%, P<0.0001). Se realizó un test de desfibrilación exitosa con ≤ 80J en 98,9% con MCPH y en 98.5% de pacientes sin MCPH. Al año de seguimiento la tasa de complicaciones fue similar en ambos grupos (92.7% versus 89.5%).Se registraron 3 choques apropiados por TV con conversión exitosa al primer choque en pacientes con MCPH. La tasa de choques inapropiados fue de 12.5% Vs. 10.3% (p=NS), en la cohorte con MCPH la principal causa fue el por sobresensado onda T (83%) y en la cohorte sin MCPH fue por TSV (75%). Los autores destacan la alta tasa de choques inapropiados en ambos subgrupos, pero señalan una reducción del 47% con la programación en doble zona en ambas cohortes a expensas de las descargas secundarias a TSV. 21
Otro estudio que también tuvo como objetivo la valoración del CDI-S en pacientes con MCPH realizado por Weinstock, et al tomó 27 pacientes con MCPH a los que se los consideró candidatos para CDI-S. El 85% fue considerado elegible tras el screening y la falla del mismo se asoció a bloqueo de rama. Se realizaron test de umbral de desfibrilación a 65, 50 y 35 Joules, 15/15 tuvieron una cardioversión exitosa a 65 Joules, 12/15 con 50J y 10/12 con 30 Joules. A los 50 Joules la falla se asoció a un aumento de índice de masa corporal. No se registraron choques apropiados a los 37 meses de seguimiento (3-35 meses) y se registró un choque inapropiado atribuible a sobresensado en un paciente en contexto de inclinación hacia adelante. Al igual que el estudio previo los autores sugieren al CDI-S como alternativa efectiva para la detección y terminación de FV (inducidas en el caso de este estudio) con un aceptable margen de seguridad en pacientes con MCPH pero requiriéndose más datos a largo plazo. Remarcan a su vez la importancia del screening preimplante en esta población.22
La miocardiopatía arrtimogénica del ventrículo derecho (MAVD) es una enfermedad hereditaria que predispone a arritmias ventriculares y muerte súbita por lo que en casos seleccionados se indica la colocación de un CDI. Los pacientes con MAVD representan una población con características específicas en cuanto a su edad menor, alta carga arrítmica, tendencia a una mayor actividad física, cambios electrocardiográficos específicos y miocardiopatía del VD, por lo que le evaluación específica de la eficacia y seguridad del CDI-S en estos pacientes fue considerada necesaria por diversos autores. Un estudio italiano publicado en enero de este año presentó 44 pacientes con MCVD a los que se les colocó un CDI-S. El 57% de los pacientes era masculino con una edad media de 37 años, 41% con indicación de CDI-S por prevención secundaria. Al momento del implante los pacientes que a lo que se les indujo TV (34/44) revirtieron con una descarga de 65J, no se evidenciaron complicaciones peri-procedimiento en ningún paciente. Se realizó un seguimiento por una media de 12 meses (7-19m). 6,8% de los pacientes presentaron complicaciones que requirieron reintervención quirúrgica (revisión del generador, movimiento del catéter, cicatrización incompleta) pero no se evidenciaron infecciones locales o sistémicas asociadas a dispositivo. El 14% de los pacientes recibieron un total de 61 choques apropiados exitosos en contexto de TV. 14% de los pacientes presentaron 8 choques inapropiados por sobresensado señales cardíacas (4 casos) y no cardíacas (4 casos), uno de los cuales requirió extracción del dispositivo. Los autores de este estudio presentan en bases a los resultados al CDI-S como una alternativa efectiva y segura para la terapia de TV maligna tanto inducida como espontanea en pacientes con MAVD. Por otro lado plantean que el riesgo de choques inapropiados y complicaciones que requieran revisión quirúrgica debe ser considerado.23
Otro estudio publicado el año anterior que incluyó 29 pacientes con MAVD a los que se les colocó un CDI realizó un seguimiento más prolongado de 3.16 (Rango IQ 2.21-4.51) años. Al momento del implante a todos los pacientes inducibles (27/29) se les realizó desfibrilación exitosa de FV inducida. A lo largo del seguimiento todos los episodios de TV (4% pacientes al año) fueron apropiadamente detectados y terminados. 21% de los pacientes presentó choques inapropiados siendo la causa más frecuente sobresensado de señales cardíacas y no cardíacas (miopotenciales especialmente). No se evidenciaron movimientos del dispositivo ni se realizaron extracciones por necesidad de ATP. Nuevamente los autores de este estudio reconocen la efectividad del CDI-S para el tratamiento de arritmias malignas espontaneas e inducidas a largo plazo en pacientes con MAVD. Señalan al igual que el otro estudio que la tasa de choques inapropiados es significativa pero que es comparable a la frecuencia observada en pacientes con MAVD con CDI-TV. 24
La prevención de muerte súbita en pediatría es una problemática compleja, la utilidad del CDI se encuentra hoy en día establecida utilizando en ocasiones de forma paralela medicación antiarrítmica o procedimientos como la simpatectomía.25,26,27. Es común la utilización del CDI-TV con un único coil o un catete/ subcutáneo asociado. La utilización del CDI presenta más complicaciones que en la población adulta (dispositivo ideado originalmente para esta población) debido a las diferencias anatómicas de los pacientes pediátricos. El acceso vascular es más dificultoso, el menor calibre de los vasos conlleva a un mayor riesgo de trombosis y fibrosis, se evidencia una mayor tasa de choques inapropiados asociados a fallas del sistema por ruptura/daño del catéter y se agrega la complicación del crecimiento lineal que lleva a la necesidad de recambio de catéter. El CDI-S evitaría la mayoría de estas complicaciones aunque no existe mucha evidencia en cuanto a su uso en niños; una complicación probable es el disconfort que podría causar en el infante el generador que es significativamente más grande que el del CDI-TV. Un estudio observacional realizado en un centro en Reino Unido analizó resultados obtenidos con dispositivos transvenosos, subcutaneos y mixtos: se evaluaron 23 pacientes con implante de CDI y edad media de 13 años, 12 de ellos tenían indicación por prevención secundaria. Se colocaron 13 CDI convencionales, 7 mixtos (coils de desfibrilación subcutáneos con sensado vía epicárdica o endocárdica) y 3 CDI-S. En cuanto al CDI-TV/mixto 5 niños requirieron 6 intervenciones extra durante el seguimiento, 3 requirieron recambio por crecimiento, 1 presentó fractura del catéter, otro presentó migración del catéter y 1 presentó endocarditis que requirió extracción del dispositivo. Ninguno de los pacientes con CDI-S requirió choques por lo que no se pudo evaluar la efectividad de los mismos, no se informaron complicaciones en el seguimiento medio de 0,83 años y no se reportó disconfort o molestias estéticas en cuanto al generador subcutáneo.25
Otra población a tener en cuenta son aquellos pacientes con cardiopatías congénitas. Existen ciertos casos de pacientes con indicación de colocación de CDI que presentan accesos vasculares de difícil o hasta imposible acceso, en estos casos el CDI-S representa una probable alternativa terapéutica. 28 Existe escasa evidencia en cuanto al uso del CDI-S en este subgrupo. Un estudio publicado por la Sociedad Europea de Cardiologia en este año estudió 20 pacientes con cardiopatía congénita que resultó en indicación de CDI y se les colocó un CDI-S (se excluyeron pacientes con canalopatías). Se evaluó tasa de choques apropiados e inapropiados y complicaciones a lo largo de un seguimiento de 36 meses. La edad media de los pacientes fue de 40 +/- 11.5 años, la Fey media fue de 46,5% +/- 11.3% y el 30% de los pacientes tenía indicación de CDI por prevención primaria. A todos los pacientes se les realizó test de desfibrilación intraoperatoria y programación del CDI-S en dos zonas. Se registraron 9 episodios de TV las cuales fueron adecuadamente revertidas. En dos pacientes se registró sobre-sensado de onda T resultando en un choque inapropiado el cual pudo ser resuelto ajustando el vector de sensado. No se registraron infecciones asociadas a dispositivo pero un paciente con tratamiento anticoagulante requirió re intervención por presentar hematoma persistente. En base a estos resultados los autores presentan al CDI-S como una alternativa segura y efectiva para la prevención de MS en pacientes con cardiopatías congénitas y variaciones anatómicas congénitas. 29
Ya analizamos el rol del CDI-S en pacientes jóvenes, la mayoría con fracción de eyección (Fey) conservada con indicación de CDI por canalopatías hereditarias, mismo los estudios EFFORTLESS y IDE, estudios prospectivos que tuvieron como objetivo valorar el la experiencia global con el CDI-S, su población de estudio consistió en su mayoría en hombres jóvenes con Fey conservada. El estudio UNTOUCHED es un estudio prospectivo tuvo como objetivo analizar el impacto del CDI-S en pacientes con Fey deprimida severa. Se analizaron pacientes con indicación primaria de CDI con fey <35% excluyéndose pacientes con antecedentes de TV sostenida, indicación de marcapaseo, estadíos finales de IC y falla renal avanzada. Se colocó el CDI-S en 1112 pacientes y se observó que en aquellos a los que se les realizó test de desfibrilación intraoperatoria (82%) el 99,2% fueron revertidos de forma exitosa y 94,3% de ellos revirtieron con 65J o menos. Se observó que el índice de masa corporal aumentado es un factor de riesgo de falla de desfibrilación con 65J o menos. La tasa a de ausencia de complicaciones a 30 días fue de 95,8% siendo las complicaciones más frecuentes asociadas a curación de la herida quirúrgica (45%) e intervenciones post test de desfibrilación o revisión de impedancia (19%). Los autores del estudio confirman en base a estos resultados que la terapia con CDI-S tiene muy bajas complicaciones perioperatorias y alta tasa de eficacia para la conversión de arritmias inducidas, aún en una cohorte de alto riesgo como son los pacientes con Fey severa y con mayor tasa de comorbilidades. 30
3.6) Limitaciones
El diseño del CDI-S conlleva a diversas limitaciones. La mayor limitación consiste en que el dispositivo no tiene la capacidad de marcapaseo o terapia anti-taquicardizante (ATP) debido a la ausencia de un cable endocavitario. La incapacidad de marcapaseo puede llevar a eventos asociados a bradicardia como el síncope o hasta la muerte. Por otro lado, las taquicardias que podrían ser resueltas con ATP requerirían su terminación con choques en pacientes con CDI-S que podrían ser evitados en pacientes con CDI-TV; a estos choques apropiados del CDI-S se los denomina “choques innecesarios”. Se debe tener en cuenta además que los choques innecesarios pueden acortar la longevidad del generador de pulso.31 Esto limita el implante de CDI-S a pacientes sin indicación actual o futura de marcapaseo incluyendo terapia de resincronización y a pacientes que no se beneficiarían de ATP por TV monomorfa1.
Otra limitación importante es el tamaño del generador del CDI-S, particularmente en niños y adultos con poco tejido subcutáneo. El generador es aproximadamente el doble del peso y el volumen del generador actualmente utilizado en el CDI-TV. El tamaño actual de 70 mL, es debido en parte a la mayor capacidad de la batería para lograr una descarga de 80 Joules. Este voltaje otorgado es mandatorio debido al mayor umbral de desfibrilación secundario a la posición extratorácica del dispositivo. El mayor tamaño del generador puede llevar a erosión de la piel, sensación de incomodidad por parte del paciente y mayores tasas de infección local respecto a los CDI convencionales. Por otro lado, el mayor tamaño puede llevar a movimiento del dispositivo una vez colocado (que se evita con una adecuada fijación del dispositivo al plano muscular en el acto quirúrgico) con consecuencias impredecibles para el algoritmo de detección y eficacia de la desfibrilación. De todas maneras en la práctica clínica ni el peso ni el tamaño representaron mayores problemas con los primeros generadores del CDI-TV los cuáles eran del mismo o mayor tamaño que el generador del CDI-S, pero la ubicación del CDI-S es diferente y el seguimiento a largo plazo es necesario para evaluar estas posibles complicaciones.31
Otra problemática planteada es la posibilidad que la descarga de alto voltaje requerida para generar un choque efectivo en el CDI-S podría generar mayor disconfort y ser más dañina en comparación por la descarga de 40 Joules generada por el CDI-TV. De todas maneras impresiona haber poca correlación entre la fuerza del choque y el grado de disconfort; y probablemente tenga que ver con el umbral de dolor de cada paciente. Se evidenció que choques de baja energía (hasta 1.0-2.5 Joules) para reversión de FA pueden producir disconfort descripto como intolerable por parte de los pacientes. Además, estudios en animales muestran que los choques generados por el CDI-S son en realidad menos dañinos para el miocardio que los generados por el CDI-TV.31
Otro aspecto mencionado previamente es que al encontrarse el dispositivo por fuera de la cavidad torácica se depende de un algoritmo de sensado de ritmo de largo alcance. Como mencionamos, previo al implante del CDI-S es necesario realizar un screening mediante electrodos de superficie para evitar el doble conteo de ondas R, sobresensado de ondas T y así asegurando un sensado adecuado. Estudios demostraron que 7-8% de los individuos fallan el screening pre implante debido a una variedad de factores incluyendo inversión de onda T, cardiomiopatía hipertrófica, ensanchamiento del QRS y relación R/T <3. 1
Las tasas de choques inapropiados no son significativamente distintas a los CDI-TV, aunque su mecanismo es distinto. Como vimos la principal causa de choques inapropiados es el sobresensado de ondas T, aún en pacientes que pasaron el screening pre-implante. Se implementaron estrategias efectivas para esta problemática incluyendo tests durante el ejercicio con posterior corrección del vector de sensado1.
Como ya vimos, el tiempo a terapia es marcadamente más prolongado en comparación al CDI-TV, pero hasta el momento no existe evidencia de consecuencias clínicas negativas secundarias a este aspecto. De hecho, como vimos, los tiempos de detección prolongada se asociaron a mejores resultados clínicos en pacientes con CDI-TV (estudio SIMPLE) y son la base de del estándar de programación actual para ambos dispositivos.1
3.7) Consideraciones a futuro ¿Asociación con otros dispositivos?
Como ya vimos previamente una de las principales limitaciones del CDI-S es la incapacidad de generar terapia de marcapasos, TRC o ATP. Es por eso que en pacientes con indicación de CDI que podrían beneficiarse de estas terapias no son candidatos hoy en día a colocación de CDI-S. Es en este contexto que toma relevancia la posibilidad de asociar el CDI-S a otros dispositivos que no requieran catéteres endocavitarios para su funcionamiento como el marcapasos (MCP) sin cables para evitar las complicaciones asociadas a los mismos. Existe actualmente poca evidencia en cuanto a la posibilidad de asociación de estos dispositivos. 32
Se realizó un estudio que tuvo como objetivo evaluar la asociación entre un marcapasos subcutáneo y MCP sin cables con capacidad de ATP asociado al CDI-S en tres modelos animales (ovino, porcino y canino) de forma aguda y crónica (90 días). Se evaluaron en este estudio la efectividad del MCP sin cables, la comunicación con el CDI-S, la capacidad de discriminación de ritmo de ambos dispositivos y la función de ATP del MCP sin cables en 40 animales a los cuales se les realizó seguimiento por 90 días. Durante el seguimiento el MCP sin cables mostró actividad adecuada en VVI por los 90 días en todos los animales. La comunicación uni-direccional entre el CDI-S y el MCP sin cables fue exitosa en el 99% de los intentos resultando en una descarga exitosa de ATP generada por el MCP en el 100% de los mismos. Por último, se evidenció adecuada capacidad de sensado durante ritmo sinusal, ritmo de marcapasos y TV/FV. 32
En el año 2015 se publicó el primer reporte de caso de la utilización en conjunto de un CDI-S y un MCP sin cables en humanos. El paciente fue un hombre de 70 años con diagnóstico de miocardiopatía dilatada con fey severa con indicación de CDI por prevención primaria. El paciente tenía antecedentes de insuficiencia renal crónica (IRC) con requerimiento de dialisis por un catéter venoso yugular derecho, en venografía pre-procedimiento se constata estenosis de ambas venas subclavias. Sin indicación de MCP al momento, se coloca CDI-S con screening previo y test de desfibrilación intraoperatorios exitosos. Diecisiete meses después paciente intercurre con un bloqueo auriculoventricular completo por lo que se coloca de urgencia un marcapasos transitorio vía femoral y en un segundo tiempo se decide colocación de MCP sin cables (Ver Figura Nº 8). Se testeó el MCP a máximo voltaje (6.5J) y esto no generó alteraciones en el sensado del CDI-S (sobresensado onda T, doble conteo) en ninguna de sus configuraciones por lo que se mantuvo la configuración de sensado previa. No se volvió a inducir FV pero se realizó un choque vía CDI-S a máximo voltaje (80J) que no resultó en alteraciones del MCP (reversión del modo, apagado o movimiento). En el seguimiento a 6 meses el paciente no volvió a presentar intercurrencias con 12% de marcapaseo ventricular, sin sincope ni descargas del CDI-S. Por otro lado al no inducirse FV los autores plantean que no se pudo descartar subsensado del CDI-S con el MCP. 33
Se realizó un estudio posterior en humanos y animales con fin de evaluar la asociación entre dispositivos evaluando su vez la funcionalidad del MCP sin cables post-choque. En este estudio se colocó un CDI-S y un MCP sin cables en dos ovejas, un MCP sin cables en un paciente con oclusión bilateral de venas subclavias que ya tenía un CDI-S y se evaluaron dos pacientes con MCP sin cables (sin CDI-S) que recibieron cardioversión eléctrica. En los experimentos realizados en ovinos la comunicación dispositivo-programador fue exitosa pero se interrumpió temporalmente la conección MCP-operador (2 +/- 2s) durante la FV inducida. La comunicación MCP-operador y la actividad de marcapasos no interfirieron con la capacidad de discriminación de ritmo del CDI-S. Todos los episodios de FV (12/12) aún con actividad de marcapasos simultanea fueron detectados y tratados por el CDI-S. No se evidenciaron alteraciones de la función del MCP post choque incluyendo reseteos o movimiento del dispositivo (24 choques CDI-S, 30 choques externos). En cuanto a los resultados con humanos el paciente con CDI-S/MCP mostró adecuado sensado durante rtimos sinusal y ritmo de marcapasos a alta frecuencia. Los dos pacientes con MCP sin cables que recibieron cardioversión externa no evidenciaron alteración del dispositivo post choque en cuanto a función o movimietnto del mismo. En base a estos resultados los autores sugieren la posibilidad de asociación entre dispositivos requiriéndose más estudios que demuestren eficacia y seguridad. 34
4) DISCUSIÓN
El cardiodesfibrilador implantable demostró ser superior al tratamiento farmacológico tanto para prevención primaria como secundaria. Es por esto que hoy en día se considera al CDI-TV como el Gold Standar para la prevención de muerte súbita.
Una de las principales causas de complicaciones del CDI-TV se asocian al catéter transvenoso, se estiman fallas de hasta un 40% a los 5 años variando ampliamente según el diseño del catéter. Los principales lugares de fricción que pueden dañar la arquitectura del catéter son: a nivel de la válvula tricúspide, por movimientos excesivos y reiterados del hombro (por ej: maratonistas), cuando el catéter ingresa a la vena subclavia en la unión de la clavícula y la primera costilla. Son frecuentes además las complicaciones médicas secundarias al cable intravascular como las infecciones asociadas al dispositivo, que pueden terminar en endocarditis con la gravedad que ello conlleva y las trombosis vasculares. Se debe tener en cuenta a su vez que en muchos casos estas complicaciones requieren extracción del dispositivo y es frecuente la fibrosis y adherencia del catéter por lo que el procedimiento puede ser dificultoso con la posibilidad de complicaciones tales como la rotura venosa, perforación cardíaca, disfunción valvular, hemotórax y hasta muerte. Es en este contexto que en el año 2008 surge el Cardiodesfibrilador totalmente Subcutáneo (CDI-S); este nuevo dispositivo representaría una herramienta alternativa para la prevención de muerte súbita evitando las múltiples complicaciones asociadas a catéter que conlleva la colocación del CDI-TV.
En cuanto a las características del dispositivo el CDI-S consta en primer lugar de un generador que es más grande y pesado que el del CDI-TV. Esta diferencia se debe a la necesidad de generar choques de alta energía (80J), casi el doble que los del CDI-TV. Tiene la capacidad de generar marcapaseo antibradicardia post choque por 30 segundos. En cuanto a la batería la longevidad original era de 5 años informándose en las primeras generaciones un agotamiento precoz de la batería que llegaba al 9% de los implantes; la segunda generación consta con un generador 20% más delgado con una longevidad 40% mayor y una vida media de 7.3 años. Consta de un cable subcutáneo que inicia su recorrido desde la porción lateral del tórax en la línea medio-axilar y continua de forma paralela al esternón contando con dos electrodos, uno proximal y otro distal con capacidad de sensado. Entre los dos electrodos se extiende el coil de desfibrilación que junto al generador cierran el circuito de desfibrilación y se generan 3 posibles vectores de sensado (primario, secundario y alternativo).
En la implementación clínica del CDI-S es fundamental el rol del screening pre implante que consiste en la colocación de 3 electrodos de superficie que simulan el sistema de sensado del CDI-S. El dispositivo cuenta con un software con capacidad de discriminación de ondas (P, QRS,T), el screening preimplante permite identificar individuos en los cuales dicha discriminación no es posible y permite evaluar en una primera instancia el vector que sense el cociente R/T más satisfactorio minimizando el riesgo de doble conteo y sobresensado onda T y por lo tanto el riesgo de choques inapropiados. El vector de sensado será nuevamente evaluado y seleccionado al momento del implante. Aquellos pacientes que fallen el screening no serán candidatos para colocación del dispositivo debido al alto riesgo de choques inapropiados. Se evidenció que la capacidad de discriminación puede verse alterada por factores tales como dilatación auricular, isquemia, bloqueos de rama, variaciones anatómicas y postura en la primera generación de dispositivos pero estas limitaciones fueron mejoradas en la 2da y 3ra generación. Se propuso en algunos estudios la realización de un test de ejercicio como screening pre-implante con fin de detectar el vector más óptimo de sensado en pacientes con alto riesgo de choques inapropiados.
El CDI-S cuenta con una programación de sensado en zonas las que permite la discriminación de arritmias y elección de terapia. Las primeras generaciones estaban programadas en una zona única de choque con un umbral de frecuencia relativamente bajo y se asociaban a una mayor tasa de choques inapropiados. En las nuevas generaciones se programó una “zona condicional” que opera en un rango de frecuencia menor y con la capacidad de analizar morfología y discriminar TSV de TV y evitar además el choque de arritmias de menor frecuencia que pueden ser autolimitadas.
En los últimos años la utilización rutinaria del test de desfibrilación intraoperatorio fue puesto en discusión en los CDI-TV, pero si parece particularmente importante su realización en los subcutáneos ya que se evidenció una tasa variable de pacientes que fallan en este test a pesar de haber tenido resultados exitosos en el screening preimplante. En pacientes que fallan el test de desfibrilación es posible ajustar el sensado y la programación en zonas intra-procedimiento.
Cuando se compara la capacidad de discriminación del CDI-S respecto del CDI-TV, ambos lograron casi un 100% de detección de TV independientemente de la programación y teniendo en cuenta solo las arritmias supraventriculares el CDI-S demostró una capacidad de discriminación mayor. La diferencia en la tasa de choques inapropiados entre ambos dispositivos no es significativa y la mayoría de los choques inapropiados del CDI-S fueron secundarios a sobresensado mientras que en el CDI-TV fueron secundarios a taquicardias supraventriculares.
En cuanto a los choques apropiados, la efectividad del CDI-S es similar a la del CDI TV, logrando revertir más del 90% de las arritmias en el primer choque.
Considerando la tasa de complicaciones asociadas al CDI-S, las más frecuentes fueron la infección no asociada a bacteriemia que resuelve con antiobioticoterapia convencional y la ubicación subóptima del electrodo o del generador durante el periodo perioperatorio. La ubicación subóptima del electrodo/generador fue resuelta en revisiones posteriores y se evidenció un descenso en las tasas de infecciones con optimización de las técnicas quirúrgicas para reducir el área de incisión, el manejo agresivo de las infecciones para evitar la extracción del dispositivo, además de la mayor experiencia de los operadores. La depleción prematura de la batería o la incapacidad de comunicarse con el programador fueron infrecuentes al igual que complicaciones asociadas al generador (erosión, hematoma, movimiento del generador de pulso, seroma del bolsillo), aunque estas si fueron más frecuentes en relación al CDI-TV y no se registraron casos de bacteriemia o endocarditis asociados al CDI-S.
Se realizaron distintos estudios que valoraron y comprobaron la seguridad y eficacia del CDI-S en poblaciones específicas: pacientes con Fey severa, cardiopatías congénitas, pacientes pediátricos y pacientes con canalopatías hereditarias. Se estudiaron además resultados del CDI-S específicamente en pacientes con miocardiopatía hipertrófica y miocardiopatía arritmogénica de ventrículo derecho que tienen alta tasa de taquicardias ventriculares por lo que se podrían beneficiar particularmente de ATP pero los resultados fueron favorables aún en estos pacientes probablemente asociado al uso cada vez más frecuente de la programación de una zona condicional al momento del implante del CDI-S.
Debemos tener en cuenta al momento de considerar el uso clínico del CDI-S las limitaciones del dispositivo. En primer lugar no cuenta con la capacidad de realizar terapia anti bradicardia por lo que hoy en día no podríamos indicar un CDI-S a pacientes con enfermedad del nodo, bloqueos sino-auriculares o auriculo-ventriculares con indicación actual o futura de marcapasos. Por otro lado el CDI-S no cuenta con la capacidad de realizar terapia anti-taquicardia la cual permitiría la resolución de arritmias sin necesidad de choque, por otro lado, como vimos, la programación de una zona condicional permite evitar descargas innecesarias. Otra limitación del dispositivo también asociada a la ausencia de catéter endocavitario es la incapacidad de generar terapia de resincronización ventricular por lo que estaría limitada su indicación en pacientes que podrían beneficiarse de la misma. Otro aspecto a considerar es el retraso en el tiempo a la descarga respecto al CDI-TV pero no se evidenciaron efectos negativos en esta materia, sino que se vió como un beneficio ya que permitiría evitar el choque innecesario en taquicardias autolimitadas.
Surge entonces ante la limitación de indicación de CDI-S en pacientes que podrían beneficiarse de terapia antibradicardia, ATP ó TRC el interés en asociar el CDI-S a otros dispositivos sin cables endovasculares con capacidad de ATP, marcapasos e incluso TRC. Hoy en día existe poca evidencia en este aspecto pero se publicaron algunos estudios que tuvieron como objetivo evaluar esta posibilidad con resultados alentadores pero que deben completarse con estudios prospectivos con seguimiento a largo plazo.
5) CONCLUSIONES
El CDI-S representa una alternativa segura y efectiva al CDI-TV para la prevención de muerte súbita primaria y secundaria en diversas poblaciones evitando las múltiples complicaciones asociadas a la utilización de un catéter endocavitario de forma indefinida. Se evidenció en estudios recientes la posibilidad de asociación del CDI-S a dispositivos complementarios por lo que sería una opción terapéutica/profiláctica para una población aún mayor en el futuro no muy lejano.
6) REFERENCIAS BIBLIOGRÁFICAS
1. Verma N, Rhyner J, Knight BP. The subcutaneous implantable cardioverter and defibrillator: Advantages, limitations and future directions. Expert Rev Cardiovasc Ther. 2015;13(9):989-999.
2. Mirowski M, Mower MM, Staewen WS, Tabatznik B, Mendeloff AI. Standby Automatic Defibrillator. 1970;126(July).
3. McLeod CJ, Boersma L, Okamura H, Friedman PA. The subcutaneous implantable cardioverter defibrillator: State-of-the-art review. Eur Heart J. 2017;38(4):247-257.
4. Yap SC, Bhagwandien RE, Szili-Torok T, Theuns DAMJ. Air entrapment causing early inappropriate shocks in a patient with a subcutaneous cardioverter-defibrillator. Hear Case Reports. 2015;1(3):156-158.
5. Darrat YH, Benn F, Salih M, Shah J, Parrott K, Morales GX, et al. Single incision technique for implantation of subcutaneous implantable cardioverter defibrillators. PACE – Pacing Clin Electrophysiol. 2018;41(11):1543-1548.
6. Waroux JP De, Ploux S, Mondoly P, Eschalier R, Strik M, Houard L, et al. Defibrillation testing is mandatory in patients with subcutaneous implantable cardioverter defibrillator to confirm appropriate ventricular fibrillation detection. 2018;15(11):642-650.
7. Adduci C, Ali H, Francia P, Mantovani R, Palano F, Lupo P, et al. The subcutaneous implantable cardioverter-defibrillator: Current trends in clinical practice between guidelines and technology progress. Eur J Intern Med. 2019;(April):1-6.
8. Frommeyer G, Zumhagen S, Dechering DG, Larbig R, Bettin M, Loher AA, et al. Intraoperative defibrillation testing of subcutaneous implantable cardioverter-defibrillator systems-A Simple Issue? J Am Heart Assoc. 2015;5(3):1-6.
9. Diemberger I, Migliore F, Ricciardi G, Ottaviano L, Tavoletta V, Francia P, et al. Time to therapy delivery and effectiveness of Subcutaneous Implantable Cardioverter–Defibrillator. Hear Rhythm. 2019.
10. Gold MR, Theuns DA, Knight BP, Sturdivant JL, Sanghera R, Ellenbogen KA, et al. Head-to-head comparison of arrhythmia discrimination performance of subcutaneous and transvenous ICD arrhythmia detection algorithms: The START study. J Cardiovasc Electrophysiol. 2012;23(4):359-366.
11. Kooiman KM, Knops RE, Nordkamp LO, Wilde AAM, Groot JR De. Inappropriate subcutaneous implantable cardioverter- de fi brillator shocks due to T-wave oversensing can be prevented : Implications for management. Hear Rhythm. 2014;11(3):426-434.
12. Burke MC, Gold MR, Knight BP, Barr CS, Theuns DAMJ, Boersma LVA, et al. Safety and efficacy of the totally subcutaneous implantable defibrillator: 2-year results from a pooled analysis of the IDE study and EFFORTLESS registry. J Am Coll Cardiol. 2015;65(16):1605-1615.
13. Gold MR, Knops R, Burke MC, Lambiase PD, Russo AM, Bongiorni M grazia, et al. The Design of the Understanding Outcomes with the S-ICD in Primary Prevention Patients with Low EF Study (UNTOUCHED). PACE – Pacing Clin Electrophysiol. 2017;40(1):1-8.
14. Neuzner J, Hohnloser SH, Kutyifa V, Glikson M, Dietze T, Mabo P, et al. Effectiveness of single- vs dual-coil implantable defibrillator leads: An observational analysis from the SIMPLE study. J Cardiovasc Electrophysiol. 2019;(5):0-2.
15. Brouwer TF, Knops RE, Kutyifa V, Barr C, Mondésert B, Boersma LVA, et al. Propensity score matched comparison of subcutaneous and transvenous implantable cardioverter-defibrillator therapy in the SIMPLE and EFFORTLESS studies. Europace. 2018;20(FI2):f240-f248.
16. Brouwer TF, Yilmaz D, Lindeboom R, Buiten MS, Olde Nordkamp LRA, Schalij MJ, et al. Long-Term Clinical Outcomes of Subcutaneous Versus Transvenous Implantable Defibrillator Therapy. J Am Coll Cardiol. 2016;68(19):2047-2055.
17. León Salas B, Trujillo-Martín MM, García García J, Ramallo Fariña Y, García Quintana A, Quirós López R, et al. Subcutaneous implantable cardioverter-defibrillator in primary and secondary prevention of sudden cardiac death: A meta-analysis. Pacing Clin Electrophysiol. 2019:1-38.
18. Caceres Monie C.1, Tello Santa Cruz I.1 , Velarde JL.2, Arabia L.3 CB., Keegan R.5, Zabala F.6, Medesani L.6, Estrada A.7, Peñafort F.8, Maid G.9 GN 1., Benjamin M11., Dubner S.12, Defeo M.13, Aversa E.14, Aguinaga Arrascue L.15 Z, J.* LC. SEGURIDAD Y EFICACIA DEL CARDIODESFIBRILADOR TOTALMENTE SUBCUTANEO: RESULTADOS DE LA EXPERIENCIA ARGENTINA. J Chem Inf Model. 2013;53(9):1689-1699.
19. Bettin M, Larbig R, Rath B, Fischer A, Frommeyer G, Reinke F, et al. Long-Term Experience With the Subcutaneous Implantable Cardioverter-Defibrillator in Teenagers and Young Adults. JACC Clin Electrophysiol. 2017;3(13):1499-1506.
20. Rudic B, Tülümen E, Berlin V, Röger S, Stach K, Liebe V, et al. Low Prevalence of inappropriate shocks in patients with inherited arrhythmia syndromes with the subcutaneous implantable defibrillator single center experience and long-term follow-up. J Am Heart Assoc. 2017;6(10):1-10.
21. Lambiase PD, Gold MR, Hood M, Boersma L, Theuns DAMJ, Burke MC, et al. Evaluation of subcutaneous ICD early performance in hypertrophic cardiomyopathy from the pooled EFFORTLESS and IDE cohorts. Hear Rhythm. 2016;13(5):1066-1074.
22. Weinstock J, Bader YH, Maron MS, Rowin EJ, Link MS. Subcutaneous implantable cardioverter defibrillator in patients with hypertrophic cardiomyopathy: An initial experience. J Am Heart Assoc. 2016;5(2):1-6.
23. Migliore F, Viani S, Bongiorni MG, Zorzi A, Silvetti MS, Francia P, et al. Subcutaneous implantable cardioverter defibrillator in patients with arrhythmogenic right ventricular cardiomyopathy: Results from an Italian multicenter registry. Int J Cardiol. 2019;280:74-79.
24. Orgeron GM, Bhonsale A, Migliore F, James CA, Tichnell C, Murray B, et al. Subcutaneous implantable cardioverter-defibrillator in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia: A transatlantic experience. J Am Heart Assoc. 2018;7(21):1-11.
25. Griksaitis MJ, Rosengarten JA, Gnanapragasam JP, Haw MP, Morgan JM. Implantable cardioverter defibrillator therapy in paediatric practice: A single-centre UK experience with focus on subcutaneous defibrillation. Europace. 2013;15(4):523-530.
26. Berger S, Utech L, Fran Hazinski M. Sudden Death in Children and adolescents. Pedriatic clinics of North America. 2002.
27. Lewandowski M, Sterliński M, MacIg A, Syska P, Kowalik I, Szwed H, et al. Long-term follow-up of children and young adults treated with implantable cardioverter-defibrillator: The authors’ own experience with optimal implantable cardioverter-defibrillator programming. Europace. 2010;12(9):1245-1250.
28. Knops RE. ´ a ser la primera eleccio ´ n El desfibrilador subcuta ´ n primaria de la muerte su en la prevencio Should the Subcutaneous Implantable Defibrillator Be the First Choice for Primary Prevention of Sudden Cardiac Death ? 2019;70(3):142-144.
29. Willy K, Reinke F, Bögeholz N, Köbe J, Eckardt L, Frommeyer G. The entirely subcutaneous ICDTM system in patients with congenital heart disease: experience from a large single-centre analysis. EP Eur. 2019:1-6.
30. Boersma L V., El-Chami MF, Bongiorni MG, Burke MC, Knops RE, Aasbo JD, et al. Understanding Outcomes with the S-ICD in Primary Prevention Patients with Low EF Study (UNTOUCHED): Clinical characteristics and perioperative results. Hear Rhythm. 2019;(June).
31. Olde Nordkamp LRA, Knops RE, Bardy GH, Blaauw Y, Boersma LVA, Bos JS, et al. Rationale and design of the PRAETORIAN trial: A Prospective, RAndomizEd comparison of subcuTaneOus and tRansvenous ImplANtable cardioverter- defibrillator therapy. Am Heart J. 2012;163(5):753-760.e2.
32. Tjong FVY, Brouwer TF, Koop B, Soltis B, Shuros A, Schmidt B, et al. Acute and 3-Month Performance of a Communicating Leadless Antitachycardia Pacemaker and Subcutaneous Implantable Defibrillator. JACC Clin Electrophysiol. 2017;3(13):1487-1498.
33. Mondésert B, Dubuc M, Khairy P, Guerra PG, Gosselin G, Thibault B. Combination of a leadless pacemaker and subcutaneous defibrillator: First in-human report. Hear Case Reports. 2015;1(6):469-471.
34. Tjong FVY, Brouwer TF, Smeding L, Kooiman KM, De Groot JR, Ligon D, et al. Combined leadless pacemaker and subcutaneous implantable defibrillator therapy: Feasibility, safety, and performance. Europace. 2016;18(11):1740-1747.
1) TABLAS Y FIGURAS