Introducción
En los pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) la angioplastia primaria es el tratamiento de elección (1). Entre el 40 al 65 % presenta otras lesiones coronarias además de la lesión culpable que ocasionó el infarto. La enfermedad coronaria de múltiples vasos en pacientes que se presentan con IAMCEST está relacionada con una elevada mortalidad en el seguimiento (2-4). Se cree que las lesiones no obstructivas (con al menos un 50 % de estenosis de la luz del vaso) son vulnerables a ruptura de placa en este contexto, pudiendo provocar infarto agudo de miocardio o muerte en el largo plazo (5-6-7).
Se propuso que la revascularización temprana de las lesiones no culpables en el contexto de IAMCEST, podría ayudar a restaurar y mejorar el aporte de sangre al miocardio restante, y a la vez tratar aquellas placas complejas que están en riesgo potencial de generar eventos isquémicos futuros (8,9).
En estudios controlados aleatorizados se puso a prueba esta hipótesis con resultados controvertidos. A partir de estos ensayos, las guías de práctica clínica han hecho mención a esta estrategia con niveles de recomendación diferentes (42-45).
El objetivo de este trabajo es analizar la evidencia que evaluó la revascularización de vasos no culpables mediante angioplastia en pacientes con IAMCEST y enfermedad coronaria de múltiples vasos sin shock cardiogénico, respecto a seguridad y eficacia.
Métodos
La evaluación de la evidencia se realizó mediante una revisión narrativa de artículos publicados.
Para identificar los estudios se realizó una búsqueda bibliográfica de artículos originales, revisiones, registros, guías de práctica clínica y diferentes publicaciones a través de los portales de Internet de la base de datos de la biblioteca nacional de los Estados Unidos (Pubmed), como también de las principales revistas de cardiología del mundo. Se analizaron secundariamente las referencias bibliográficas de los artículos más relevantes.
Se utilizaron como parámetros de búsqueda los siguientes términos:
“ST-segment elevation myocardial infarction,”“coronary stenting,”“multivessel,” “nonculprit,”, “complete revascularization”, “percutaneous coronary intervention”, “coronary angioplasty” y “coronary artery disease”.
No se aplicaron restricciones de lenguaje ni de fechas.
Desarrollo
Características de las placas de ateroma en el síndrome coronario agudo
La causa más común de síndromes coronarios agudos (SCA) es la ruptura de placas ateroescleróticas. La gran mayoría se caracteriza por contener un gran núcleo necrótico con una capa fibrosa delgada. La ruptura de la capa fibrosa permite la exposición del núcleo necrótico que es altamente trombogénico con la consecuente adhesión de las plaquetas y trombosis endoluminal aguda (10-12).
Los estudios patológicos han sugerido que la lesión precursora de la ruptura de la placa de ateroma es el llamado “fibroateroma de capa delgada”, una lesión vulnerable a la ruptura (13).
Esta información ha surgido a partir de estudios histológicos realizados en autopsias, y recientemente mediante estudios de ultrasonido intravascular (IVUS), considerado el gold standard para detectar ruptura de placa in vivo (5).
Pequeños ensayos que realizaron IVUS, han mostrado diferencias en las características de la placa entre pacientes con SCA y enfermedad coronaria estable: en el SCA, las lesiones no culpables tienden a tener características de mayor riesgo como enfermedad coronaria difusa, menor calcificación de las placas de ateroma con una capa delgada y un mayor porcentaje de núcleo lipídico, lo que las hace propensas a la ruptura (5-6).
A la vez, se ha descripto un estado pro-inflamatorio en el paciente con SCA. Se cree que el mecanismo responsable de la transformación de una lesión aterosclerótica no complicada a una lesión ulcerada y hemorrágica o a una ruptura de placa con la subsiguiente aparición de un cuadro clínico agudo, se debe a la puesta en marcha de una respuesta inflamatoria. La inflamación conduce a una serie de cambios en la superficie vascular (como la infiltración de monocitos, proliferación de células musculares lisas y expresión de moléculas de adhesión) que activan la adhesión y agregación de las plaquetas y favorecen la formación de un trombo. Se han observado niveles elevados de marcadores inflamatorios en pacientes con SCA, lo que refleja la presencia de inflamación generalizada que puede derivar en el desarrollo de múltiples lesiones coronarias inestables en todo el árbol coronario. Esta información respalda la hipótesis de una distribución pancoronaria de placas potencialmente vulnerables a la ruptura en pacientes con SCA, lo que puede llevar a eventos recurrentes luego del evento agudo inicial (13,14).
Se cree que la intervención de lesiones no culpables peri-IAMCEST, puede conducir a la estabilización de placas potencialmente vulnerables en un entorno pro-inflamatorio, con la consecuente disminución del riesgo de trombosis y con posibles efectos saludables en el miocardio isquémico aturdido (6).
Impacto de lesiones no culpables en la mortalidad
A pesar de la restauración del flujo sanguíneo epicárdico anterógrado mediante la angioplastia primaria en contexto de IAMCEST, una proporción significativa de pacientes siguen teniendo un mayor riesgo de muerte y resultados adversos.
Al momento de la intervención percutánea primaria se puede evidenciar la extensión angiográfica de la enfermedad coronaria, siendo este dato junto a la función sistólica del ventrículo izquierdo, las mejores medidas pronósticas del paciente con IAMCEST.
A la vez, también influyen otras características clínicas tales como la edad, clasificación de Killip y Kimbal, insuficiencia renal, grado de flujo TIMI posterior al procedimiento (15).
Los pacientes con enfermedad coronaria significativa de otros vasos tienen mayor incidencia de mortalidad y re-infarto que aquellos con enfermedad de un único vaso. El pronóstico se relaciona directamente con la extensión de la enfermedad coronaria, con mayor impacto adverso en aquellos que tienen afección de múltiples vasos (16).
En un estudio de 2082 pacientes que se sometieron a una angioplastia primaria, la incidencia acumulada de muerte durante un año para pacientes con enfermedad de uno, dos y tres vasos fue de 3,2, 4,4 y 7,8 % (p = 0,003), y la tasa compuesta de eventos cardíacos adversos mayores (MACE) fue de 14,8, 19,5 y 23,6%, respectivamente (p = <0,001), siendo la enfermedad de tres vasos el predictor más fuerte de mortalidad al año, de re-infarto y MACE (4).
El impacto adverso de la enfermedad multivaso plantea la cuestión de si la revascularización de estas lesiones en contexto de IAMCEST mejoraría el pronóstico de estos pacientes.
Manejo de lesiones no culpables
Las estrategias de revascularización para lesiones no culpables en pacientes hemodinámicamente estables luego de la angioplastia primaria, varían desde un enfoque agresivo a un enfoque más conservador:
- Tratamiento solo de lesión culpable (RVC), seguido posteriormente de revascularización de vasos no culpables guiadas por síntomas de isquemia o pruebas evocadoras de
isquemia.
- Revascularización completa de lesión culpable y lesiones no culpables durante el procedimiento inicial (revascularización múltiples vasos – RMV)
- Revascularización de la lesión culpable seguida de RMV (durante la misma hospitalización o poco tiempo después) (7-8).
Hay otros factores que influyen en el tratamiento de los pacientes con IAMCEST y afección de múltiples vasos sometidos a angioplastia primaria:
Factores clínicos: edad, comorbilidades, estabilidad hemodinámica, función sistólica del ventrículo izquierdo, función renal, diabetes.
Factores del procedimiento: complejidad, duración, cantidad del contraste utilizado, resultado final.
Características de las lesiones: complejidad/score de Syntax, número de vasos afectados, oclusión total de otros vasos, calcificaciones (16).
Puntos a favor y en contra de la revascularización de lesiones no culpables Como ya se ha planteado, los pacientes con IAMCEST que se presentan con enfermedad de múltiples vasos presentan un peor pronóstico temprano y tardío.
Beneficios potenciales de la revascularización completa
Se exponen varias ventajas potenciales de realizar RMV en la etapa aguda (durante el procedimiento primario):
- La restauración completa del flujo sanguíneo durante la fase aguda en los vasos lesionados puede aumentar aporte de sangre al miocardio, mejorando así la función ventricular.
- Esta estrategia también disminuye el riesgo de complicaciones vasculares en el sitio de acceso asociadas con punciones vasculares repetidas.
- Reduce el tiempo de hospitalización con un impacto relevante en los costos de atención médica.
- Se planteó que al realizar RMV en la etapa aguda donde predomina un estado proinflamatorio y pro-trombótico, se estaría tratando placas potencialmente vulnerables susceptibles a ruptura.
Por otro lado, en cuanto a la RMV en forma diferida, al hacerlo fuera de la etapa aguda disminuiría el riesgo de trombosis del stent.
Riesgos de la revascularización completa
A su vez, el hecho de tratar las lesiones no culpables puede tener riesgos asociados al mismo procedimiento y al estado general del paciente. Estos riesgos incluyen:
- Mayor compromiso trombótico e inflamatorio en el infarto, con el riesgo de producirse trombosis del stent, infartos de otros territorios, recurrencia de la isquemia, pudiendo deprimir aún más la función ventricular que ya está comprometida por el evento coronario agudo inicial.
- Complicaciones asociadas al mismo procedimiento: disección de vaso tratado, hemorragias y hematomas si se realiza angioplastia en forma diferida.
- Mayor riesgo de falla renal aguda asociado al uso de contraste y al tiempo mayor del procedimiento.
- Mayor exposición a la radiación (8, 9, 17).
Es por eso que a la hora de decidir la RMV en este tipo de pacientes, se debe tener en cuenta los posibles riesgos y beneficios.
Estudios observacionales
Los estudios observacionales realizados antes de los ensayos aleatorizados y sus metaanálisis, concluyeron que el tratamiento conservador de revascularización de vaso culpable (RVC) únicamente, en oposición a la revascularización de múltiples vasos (RMV) en el momento del procedimiento percutáneo inicial condujo a mejores resultados.
Sin embargo, cuando la RMV era realizada por etapas, tanto durante la hospitalización como luego del egreso hospitalario, los resultados a corto y largo plazo fueron más favorables para este grupo (7).
Es importante destacar que, a diferencia de los ensayos clínicos aleatorizados que se realizaron más tarde, los estudios observacionales compararon la RVC con la revascularización de múltiples vasos (RMV) sin poder controlar si se realizó la revascularización completa de todas las lesiones.
Uno de los mayores estudios publicados fue el de Cavender y col. en 2009, que incluyó un registro de más de 30000 pacientes, de los cuales el 10% recibieron RMV; obtuvo como resultado mayor mortalidad hospitalaria para pacientes sometidos a RMV en comparación a RVC (18). Este estudio excluyó a los pacientes sometidos a angioplastia en forma diferida e incluyó a pacientes de mayor riesgo (shock cardiogénico, insuficiencia cardíaca congestiva y función sistólica menor al 30%).
Del mismo modo, otros estudios retrospectivos con menor número de pacientes habían demostrado mejores resultados para la RVC (19-23).
Cuando se investigó la RMV por etapas, la mayoría de los estudios sugirieron mejores resultados para la revascularización en diferido cuando se la comparó con RVC y RMV en el procedimiento inicial.
Varios metaanálisis han examinado los estudios observacionales y realizaron un análisis de la RVC y la RMV tanto en el procedimiento inicial como en diferido. Uno de los mayores el de Vlaar y col, que incluyó más de 40000 pacientes; como resultado obtuvo una tasa de mortalidad más alta con RVC a corto plazo, mientras que la angioplastia diferida se asoció con una menor mortalidad a corto y largo plazo en comparación con
RVC y RMV en la etapa aguda (24). En otro metaanálisis Bangalore y col, que incluyó 60000 pacientes encontró una disminución de MACE con menores tasas de revascularización repetida a corto plazo, y una disminución en la mortalidad, revascularización repetida y MACE a largo plazo en RMV. Sin embargo, este estudio analizó la RMV sin diferenciar si se realizó durante la angioplastia primaria o en forma diferida (25).
Es importante destacar que en los estudios observacionales, los pacientes que recibieron RMV tuvieron mayor riesgo (mayor Killip y Kimball o en shock cardiogénico) por lo tanto, el riesgo de mortalidad fue mayor en el procedimiento inicial en estos estudios (sesgo por confusión). Además, dado que globalmente los pacientes eran de más riesgo, esto podría haber determinado los resultados de los procedimientos (sesgo por indicación).
Estudios aleatorizados
En los últimos años, se han realizado varios ensayos clínicos aleatorizados (ECA) para investigar la eficacia de la angioplastia de las lesiones no culpables en el contexto de IAMCEST.
El primero de estos ensayos fue el “Tratamiento vaso culpable versus el tratamiento multivaso durante la angioplastia primaria: resultados de un ensayo multicéntrico aleatorizado (HELP-AMI)” en 2004, que incluyó 69 pacientes y utilizó stent recubierto con heparina, de los cuales 52 recibieron RMV. Como resultado del punto final primario obtuvo una tendencia a mayor requerimiento de revascularizaciones repetidas en el grupo RVC en el seguimiento a 12 meses (35 vs 17%; p= 0,247), sin diferencias en los eventos cardiovasculares mayores durante la hospitalización (35 vs 21 %; p = 0,331). Este estudio tuvo poco poder y se centró principalmente en la seguridad de la RMV (26).
En un estudio posterior, Politi y col en 2010, evaluó 263 pacientes, que fueron asignados aleatoriamente a RVC, RMV en el procedimiento inicial o RMV por etapas. Los investigadores encontraron que la RVC tuvo una tasa más alta de MACE (50%), en comparación con la revascularización por etapas (20%) y la revascularización completa inmediata (23%) en un seguimiento medio de 2.5 años (p <0,001). Este resultado fue impulsado principalmente por una menor incidencia de muerte intrahospitalaria, revascularización y re-hospitalización; no hubo diferencias significativas en los resultados entre los grupos de revascularización completa inmediata y por etapas (27).
Es de destacar que fue el único de los ensayos que separó las tres estrategias, y que utilizó principalmente stents metálicos: el 25% de los pacientes recibieron stents liberadores de drogas (DES).
Hubo además otros ECA más pequeños como el realizado por Ghani y col (28) en 2012 con 121 participantes que evaluó revascularización del vaso no culpable guiada por FFR en forma diferida, con un seguimiento a 3 años, en el cual no se detectaron diferencias significativas en la incidencia de MACE; el PRAGUE-13 en 2015 (29) que reclutó 214 pacientes y realizó RMV en forma diferida con un seguimiento de 23 meses, y en el que tampoco se demostraron diferencias en MACE entre ambas estrategias; y Hamza y col (30) en 2016 que incluyó 100 pacientes diabéticos, observando que la RMV (realizada tanto en el procedimiento inicial como en diferido) redujo el MACE a los 6 meses de seguimiento, a expensas de disminución en la necesidad de nueva revascularización.
En el último tiempo, se han desarrollado múltiples ensayos aleatorios más grandes y contemporáneos: PRAMI, CvLPRIT, DANAMI3-PRIMULTI, COMPARE-ACUTE. Si bien cada uno de estos ensayos tenía una metodología y criterios de inclusión ligeramente diferentes, todos coincidieron en la superioridad de la revascularización completa, ya sea durante el procedimiento inicial o en etapas, con una disminución global de MACE con resultados variables sobre el re-infarto (disminución de la tasa de infartos en el PRAMI) sin impactos sobre la muerte cardiovascular o total.
Recientemente, en septiembre del 2019, se ha publicado el ECA de mayores dimensiones que abordó este tema: el estudio COMPLETE, que reclutó más de 4000 pacientes y tuvo el poder estadístico suficiente para examinar los puntos finales “duros” de muerte cardiovascular e infarto agudo de miocardio.
PRAMI “Angioplastia preventiva en pacientes con IAMCEST”, 2013
En este estudio 465 pacientes fueron asignados aleatoriamente a RVC (n = 231) o RMV durante el procedimiento de inicial (n = 234). Se incluyeron pacientes con lesiones coronarias de al menos el 50%, luego de tratar la arteria culpable del infarto. Se excluyeron pacientes en shock cardiogénico, con antecedente de cirugía de revascularización coronaria (CRM), lesión ≥50% en el tronco de la coronaria izquierda u ostium de la arteria descendente anterior y circunfleja, o si la lesión no culpable era solo una oclusión crónica total.
El punto final primario fue un combinado de muerte cardiovascular, infarto de miocardio no fatal o angina refractaria con un seguimiento medio de 23 meses, y fue significativamente menor dentro del grupo RMV (9%) en comparación con el grupo RVC (23%) (hazard ratioHR- 0,35; p <0,001). La reducción del 65% del total de los eventos, se debió principalmente a una reducción significativa en la angina refractaria y el infarto no fatal; sin reducción significativa en la mortalidad.
La RMV también redujo significativamente el punto final secundario de necesidad de nueva revascularización.
El estudio fue suspendido prematuramente por las diferencias en el punto final primario a favor de RMV.
Entre las limitaciones del estudio se puede mencionar que es un ensayo abierto (puede introducir un sesgo, ya que los pacientes asignados al azar a RVC son más propensos a recibir revascularización posteriores debido a que los médicos tratantes son conscientes que hubo lesiones que no fueron tratadas previamente); no tuvo el poder necesario para evaluar los puntos finales duros; más del 50% de los pacientes evaluados no fueron incluidos (posible sesgo de selección), no se proporcionó información de las lesiones no culpables (flujo TIMI final o características de la lesión); entre los pacientes con RVC hubo una mayor proporción de pacientes diabéticos y con infarto anterior, lo que podría haber influido en el peor pronóstico en este grupo; no especificó el momento de la realización de la RMV si durante el procedimiento inicial o como un segundo procedimiento. Tampoco se evaluaron puntos finales de seguridad (31).
CvLPRIT (Revascularización completa versus de vaso culpable en pacientes sometidos a angioplastia primaria en contexto de IAMCEST y enfermedad de múltiples vasos, un estudio randomizado), en 2015
El ensayo aleatorizó a 296 pacientes a RVC (n = 146) o RMV (n = 150). Los criterios de exclusión fueron <18 años, contraindicación para la angioplastia de vasos no culpables según el criterio del operador, infarto previo, CRM previo, shock cardiogénico, ruptura del septum interventricular o insuficiencia mitral moderada / grave, enfermedad renal crónica, sospecha o confirmación de trombosis de una arteria con stent previamente, y cuando la única lesión significativa no relacionada con el infarto es una oclusión total crónica.
La revascularización completa se realizó durante el procedimiento inicial (64% de los pacientes) o durante la hospitalización (36%).
El punto final primario era MACE (combinación de mortalidad por todas las causas, infarto de miocardio recurrente, insuficiencia cardíaca y revascularización por isquemia) a los 12 meses. El ensayo evidenció una reducción del 55% de MACE, siendo significativamente menor en el grupo de RMV (10%) que en el grupo RVC (21,2%) (p=0,009), sin reducciones significativas en los componentes individuales del punto final combinado.
Además, el estudio evaluó la seguridad de ambas estrategias: accidente cerebro-vascular (ACV), hemorragia grave, nefropatía por contraste sin evidenciar diferencias significativas entre ambas estrategias.
Entre las limitaciones cabe mencionar que se trata de un ensayo clínico abierto; no tuvo el poder estadístico necesario para evaluar los componentes individuales del punto final primario ni eventos duros; no fue protocolizado el tiempo de revascularización completa (en el procedimiento inicial o en etapas), por lo cual no queda claro cuál de estas dos estrategias es superior (32).
DANAMI-3 PRIMULTI (Tercer estudio danés sobre el tratamiento óptimo de pacientes con IAMCEST: angioplastia primaria en enfermedad multivaso), en 2015 Fueron asignados aleatoriamente 627 pacientes a RMV (n = 314) o RVC (n = 313). Se incluyeron pacientes con estenosis ≥50% en una o más arterias no relacionadas con el infarto luego de la angioplastia exitosa del vaso culpable. Los pacientes fueron excluidos si no toleraban los medios de contraste, anticoagulantes o antitrombóticos, aquellos que estaban inconscientes, en shock cardiogénico, si tenían una trombosis del stent como causa del infarto, si cumplían con criterios de CRM o tenían alto riesgo de hemorragia.
La revascularización completa se realizó guiada por medición de Reserva del Flujo Fraccional coronario (FFR, por sus siglas en inglés) y en diferido luego de 48 hs del procedimiento inicial durante la estadía hospitalaria. En las lesiones no culpables con una estenosis mayor al 50%, se calcularon los valores de FFR, si era ≤0,8 eran consideradas significativas.
Un tercio de los pacientes asignados al grupo de revascularización completa no recibió revascularización ya que tenían valores de FFR >0,80.
El punto final primario que era un combinado de muerte, re-infarto y revascularización impulsada por la isquemia en una mediana de seguimiento de 27 meses, y se alcanzó en el 13% del grupo RMV en comparación con el 22% en el grupo RVC (p=0,004), con una disminución del 44% del riesgo de eventos. Sin embargo, esto se debió principalmente a una disminución de la necesidad de revascularizaciones: 5% en el grupo RVM versus 17% en el grupo RVC (p<0,001), sin diferencias significativas en mortalidad cardiovascular e infarto no fatal.
Se evaluó la seguridad de ambos procedimientos: infarto peri-procedimiento, sangrado con requerimiento de transfusión o cirugía, nefropatía por contraste, ACV: sin diferencias significativas entre ambos grupos.
Entre las limitaciones de este ensayo se pueden mencionar que no tuvo el poder necesario para mostrar el impacto en los eventos duros (como la muerte y el infarto); es un estudio abierto; y no comparó el momento de realización de revascularización completa: si en el procedimiento inicial o en diferido (33).
COMPARE-ACUTE “Angioplastia guiada por FFR en pacientes con infarto agudo de miocardio”, en 2016
Incluyó a 885 pacientes con IAMCEST con enfermedad de otros vasos coronarios y estenosis ≥50%, los que fueron asignados aleatoriamente en una relación de 2:1 a RVM guiada por FFR (n = 295) o RVC (n = 590). Los criterios de exclusión fueron lesión de tronco de la coronaria izquierda, oclusión total crónica, estenosis severa con un flujo TIMI < de 2 en la arteria coronaria no relacionada con el infarto, resultado subóptimo o complicación luego del tratamiento de la arteria culpable, disfunción valvular grave y Killip y Kimball clase III o IV.
La revascularización completa se realizó en lesiones con FFR ≤0,80, dentro de las 72 horas (en el 83,4% de los pacientes fue realizado durante el procedimiento inicial). La medición de FFR se realizó en ambos grupos y se demostró que aproximadamente la mitad de los pacientes tenían una o más lesiones no relacionadas con el infarto con un FFR de 0,80 o menos.
El punto final primario de muerte por todas las causas, infarto no fatal, revascularización y eventos cerebrovasculares a los 12 meses ocurrió en el 8% del grupo RVM y el 21% del grupo RVC (HR 0,35; IC 0,22 a 0,55; p<0,001), y esto se debió principalmente a una diferencia significativa en la necesidad de futuros procedimientos de revascularización. El punto final secundario mostró menor tasa de revascularización y re-internaciones en el grupo RVM. No hubo diferencias en el punto final de seguridad (hemorragia mayor y trombosis del stent).
A diferencia del ensayo DANAMI3-PRIMULTI, el ensayo COMPARE-ACUTE cegó a los cardiólogos a los resultados de FFR para controlar el sesgo del observador, e investigó el papel de las revascularizaciones guiadas por FFR durante el procedimiento inicial, apoyando esta estrategia como segura y económica.
Como limitantes es importante destacar que el ensayo no fue diseñado para detectar diferencias en eventos duros; los pacientes asignados a RVC podrían someterse a revascularización a discreción del cardiólogo tratante (que ocurrió en 59 pacientes), ya que estos desconocían el resultado del FFR pero no así de la angiografía. Esto pudo conducir a una subestimación del beneficio de la revascularización completa guiada por FFR, sin embargo, la tasa de MACE al 1 año se mantuvo significativamente más baja en este grupo (34).
COMPLETE (Revascularización completa versus vaso culpable para tratar la enfermedad multivaso luego de la angioplastia primaria en pacientes con IAMCEST) en 2019
Este ensayo de grandes dimensiones, multicéntrico, realizado en 31 países, que reclutó 4041 pacientes, comparó la estrategia de RMV en forma diferida versus RVC en pacientes con IAMCEST y enfermedad de múltiples vasos. Fue diseñado principalmente para evaluar reducción de muerte cardiovascular e infarto a favor de RMV.
Se incluyeron pacientes con lesiones coronarias no culpables con al menos un 70% de estenosis o una medición de FFR menor o igual a 0,80 en aquellos con lesiones del 5059%. Fueron aleatorizados hasta las 72 horas luego del procedimiento percutáneo inicial, en una relación 1:1. El tratamiento de las lesiones no culpables podía realizarse durante la misma internación luego del tratamiento del vaso culpable, o después del egreso hospitalario y hasta los 45 días.
Entre las características de los pacientes mayoritariamente eran hombres (80%), el 77% tenía tan solo una lesión adicional además de la culpable, y la media de estenosis era de 80%.
Tras una mediana de seguimiento de 3 años, el punto final combinado de muerte cardiovascular e infarto se produjo en 7,8% en el grupo de RMV en comparación 10,5% RVC (HR 0,74; IC 95% 0,60 a 0,91; p=0,004), a expensas de la reducción del número de infartos (5,4% versus 7,9%; HR 0,68; IC 95% 0,53 a 0,86), sin diferencias en la mortalidad cardiovascular (2,9% y 3,2%, HR 0,93; IC 95% 0,65 a 1,32). El punto final secundario combinado de muerte cardiovascular, infarto y revascularización fue de 8,9% en el grupo RMV versus 16,7% en el RVC (HR 0,51; IC 95% 0,43 a 0,61; p<0,001). En cuanto al requerimiento de revascularización, en el grupo RMV se redujo el riesgo a la mitad en comparación con RVC.
El riesgo de eventos adversos (incluyendo accidente cerebrovascular, hemorragia grave y lesión renal aguda) fue similar en los dos grupos.
Para ambos resultados combinados, el beneficio de RMV se mantuvo independientemente del momento de la revascularización de los vasos no culpables. Entre pacientes que fueron asignados aleatoriamente para someterse a una RMV, un tercio tuvo el segundo procedimiento después del egreso hospitalario.
Como limitaciones del ensayo se pueden mencionar que tuvo un diseño abierto, con entrecruzamiento entre ambos grupos; no se evaluó la estrategia de RMV en el procedimiento percutáneo inicial; eran pacientes de menor riesgo, con score de SYNTAX bajo, por lo tanto las lesiones más complejas asociadas con un score de SYNTAX más alto, pueden ser fisiológicamente diferentes y tener una mayor complejidad para la realización de revascularización mediante angioplastia.
A pesar de que demostró beneficio en el punto final combinado de muerte cardiovascular e infarto a favor de RMV, este beneficio no se reflejó disminución en el riesgo de mortalidad cardiovascular (53, 56)
Metaanálisis
Desde los ensayos clínicos aleatorizados se han realizado y publicado varios metaanálisis con resultados discordantes.
En 2015, Bhatt realizó un análisis agrupado de los ensayos PRAMI 2013 y CvLPRIT 2015 y demostró que la estrategia de RVM en comparación con RVC se asoció con tasas más bajas de mortalidad cardiovascular, revascularización e infarto agudo de miocardio (35).
En un metaanálisis de Elgendy y col en 2015, que incluyó diez ensayos clínicos aleatorizados con 2285 pacientes, se evaluaron las diferentes estrategias implementadas (RVC, RMV en el procedimiento inicial, RMV durante la internación antes del egreso hospitalario y RMV luego del egreso hospitalario). Los resultados sugieren que el riesgo de mortalidad por todas las causas y re-infarto no fue diferente entre las cuatro estrategias. Las tres estrategias de RMV se asociaron con una reducción del riesgo de MACE debido a una reducción en la revascularización repetida, sin diferencias entre ellas (ver Figura 1) (36).
Un metaanálisis más reciente de la Colaboración Cochrane de 2017 que analizó nueve estudios randomizados con 2633 pacientes diferenció las estrategias RMV vs RVC. La RMV fue superior debido a menores proporciones de mortalidad cardiovascular a largo plazo, revascularización a largo plazo y re-infarto no fatal a largo plazo, pero estos hallazgos se basan en evidencia de muy baja calidad. También evaluó la seguridad sin encontrar diferencias en ambas estrategias (37).
Una variedad de otros metaanálisis han demostrado diferencias en los efectos de las distintas estrategias, aunque en todos los casos reflejaron mejores resultados con estrategia de RMV (38-40).
Como se puede observar, los resultados de los metaanálisis fueron diversos debido principalmente a la heterogeneidad de los estudios incluidos y a la falta de poder para encontrar diferencias en los puntos finales duros (mortalidad e infarto).
En general, la RMV se relacionó con un menor riesgo de MACE y revascularización repetida, con resultados variables en los puntos finales de infarto de miocardio y mortalidad en comparación con la RVC.
Es importante destacar que estas metaanálisis no incluyen al último y más grande ECA (COMPLETE trial) al haber sido publicado recientemente.
Por tal motivo presento un análisis de revisión sistemática/metaanálisis con los ECA más importantes incluido el COMPLETE, en el que se observa que la RMV disminuye el requerimiento de nueva revascularización y la incidencia de infarto, sin impacto sobre la mortalidad cardiovascular ni global, ni en el punto final de seguridad (ver tablas 1-5, ver figuras 1-5).
Tiempo de revascularización
La variabilidad en el diseño de los ensayos llevan a una incertidumbre y confusión acerca de cuándo y cómo la revascularización del vaso no culpable debe realizarse.
Como ya fueron comentadas, las opciones potenciales incluyen realizar una revascularización completa durante el procedimiento inicial o como un procedimiento electivo planificado durante la hospitalización inicial o después del alta. Hasta la fecha, solo un ensayo pequeño analizó las diferentes estrategias de revascularización completa
(Politi y col), sin encontrar diferencias entre ellas. PRAMI comparó específicamente la
RMV en el procedimiento inicial versus RVC, mientras que DANAMI3-PRIMULTI y COMPLETE analizaron solo la RMV diferida versus RVC. Los otros dos ensayos más grandes CvLPRIT y COMPARE-ACUTE fueron diseñados para realizar una RMV en la fase aguda, pero permitieron la revascularización por etapas, que ocurrió en una minoría de los casos.
Al observar las curvas de Kaplan Meier (tiempo al evento) de los ensayos mencionados anteriormente, éstas comienzan a separarse desde el principio, presumiblemente indicando que una estrategia de revascularización inmediata o muy temprana podría ser beneficiosa. Esta hipótesis se complementa con el metaanálisis de Wang y cols que realizó un análisis por subgrupos, comparando los resultados de la RMV en el momento del procedimiento inicial, RMV en diferido y RVC. La RMV inmediata tuvo una incidencia significativamente menor de MACE, muerte por todas las causas y/o infarto, infarto no fatal y revascularización repetida en comparación con la RVC. La RMV en diferido redujo solo la incidencia de MACE (41).
Pero por otro lado, el beneficio de la estrategia de revascularización completa inmediata no se ha confirmado en otros metaanálisis y en los diversos estudios observacionales publicados. En un análisis post hoc del ensayo HORIZONS-AMI realizado por Kornowski y cols, originalmente diseñado para comparar bivalirudina versus heparina más un inhibidor de la glucoproteína IIb/IIIa y stents liberadores de paclitaxel versus stents metálicos en pacientes sometidos a angioplastia primaria en IAMCEST, la RMV durante el procedimiento inicial se asoció con un aumento de la mortalidad por todas las causas y cardiovascular en comparación con la RMV por etapas en un total de 668 pacientes (42).
Del mismo modo, un metaanálisis realizado por Tarantini y cols demostró que la estrategia de RMV en forma diferida estaba asociada con una mayor sobrevida a corto y a largo plazo (43).
Como ya fue citado, el metaanálisis de Elgendy y cols que analizó las diferentes estrategias de revascularización completa, no encontró diferencias entre las mismas (36).
Debido a los diferentes resultados, es necesario la realización de un estudio clínico aleatorizado con el poder apropiado para determinar el momento óptimo para la revascularización de los vasos no culpables en el caso de que esta estrategia sea beneficiosa.
Rol del FFR
La mayoría de los estudios observacionales y aleatorizados se han basado en estimaciones visuales mediante angiografía para determinar la gravedad de las lesiones no culpables.
Previamente el FFR no se ha utilizado en el SCA debido a la hipótesis de que la disfunción microvascular aguda podría influir en los resultados y a la vez, la gravedad de la estenosis de las lesiones no culpables podría exagerarse por el estado de vasoconstricción generalizada predominante en este tipo de pacientes (44-46).
Un estudio realizado por Ntalianis y cols evaluó la fiabilidad de FFR en las lesiones no culpables durante el procedimiento percutáneo agudo en pacientes con infarto agudo de miocardio hemodinamicamente estables: fueron reclutados 75 pacientes con IAMCEST, se obtuvieron mediciones de FFR inmediatamente después de la angioplastia primaria y se repitieron entre los 3 días y los 3 meses (media de 35 días) posteriores al evento agudo. No se evidenciaron cambios en las lesiones entre el evento agudo y el seguimiento (0,77 +/- 0,13 versus 0,77 +/- 0,13, respectivamente, p=NS). Concluyeron que las mediciones de FFR son seguras y confiables para evaluar el grado de estenosis real de los vasos no culpables durante el procedimiento percutáneo primario (47).
El ensayo COMPARE-ACUTE demostró una discrepancia entre las lesiones coronarias significativas medidas por angiografía y las evaluadas por FFR: encontró que aproximadamente la mitad de las lesiones no culpables que se consideraron críticas mediante angiografía tenían un valor de FFR >0,80 y, por lo tanto, no eran fisiológicamente relevantes (34).
Tanto el ensayo DANAMI3-PRIMULTI (33) como el COMPARE-ACUTE mostraron que la revascularización guiada por FFR disminuyó las tasas de revascularización aguda y repetida, aunque no se observó beneficio en las tasas de mortalidad o re-infarto.
Como ya se ha mencionado en el ensayo COMPLETE, la estrategia para realizar RMV se basó principalmente en las estimaciones angiográficas (lesiones mayores del 70%), aunque también incluyó mediciones guiadas por FFR en lesiones entre el 50-69 %, que representaron solo el 1% de los pacientes reclutados. Los autores de este estudio hacen la mención de que no está claro el rol del FFR en los puntos finales duros, ya que sostienen que es posible que lesiones angiográficamente significativas pero con un FFR >0,80 puedan tener características morfológicas de placas inestables con un riesgo aumentado de eventos recurrentes.
A modo de resumen, realizar FFR durante el procedimiento percutáneo inicial es un procedimiento seguro, que brinda información más fehaciente acerca del grado de estenosis de la lesión coronaria pero no así de la morfología de la placa y del riesgo de ruptura.
Recomendaciones de las guías
Impulsados por los resultados contradictorios de los estudios observacionales con las limitaciones que presentan este tipo de estudios, las recomendaciones publicadas por la American College of Cardiology / American Heart Association (ACC / AHA) en 2013 contraindicaban la revascularización de lesiones no culpables al momento de la angioplastia primaria en pacientes con IAMCEST hemodinámicamente estables (clase III) (48) ; la Sociedad Europea de Cardiología / Asociación Europea de Cirugía CardioTorácica 2014 recomendaba angioplastia de vaso culpable únicamente con consideración de realizar revascularización del vaso no culpable ante síntomas de isquemia (Clase IIa) o revascularización inmediata de vasos no culpables en casos seleccionados durante el procedimiento inicial (Clase IIb) (49).
En los últimos años, varios estudios randomizados han demostrado mejorías en los resultados a favor de la revascularización completa en IAMCEST, y proporcionaron la evidencia para las principales guías de referencia.
A partir de esto la guía de la ACCF/AHA fue actualizada en el 2015, en donde la revascularización del vaso no culpable debe considerarse en pacientes seleccionados, hemodinamicamente estables, con IAMCEST y enfermedad de múltiples vasos, tanto en el procedimiento inicial como por etapas: recomendación clase IIb (50).
De manera similar la ESC del 2017 cambió la guía expresando que debe ser considerada una revascularización de rutina de los vasos no culpables en pacientes con IAMCEST y enfermedad de múltiples vasos antes del egreso hospitalario: recomendación clase IIa
(51).
La Sociedad Argentina de Cardiología del 2015 se asemeja más a la recomendación de la guía Europea, manifestando que se debe considerar realizar angioplastia de lesiones no culpables, en pacientes estables, siempre que sean graves (>70% por estimación visual o ≤0,80 por FFR), realizada de preferencia, antes del alta (en etapas) o en el mismo momento, luego de tratar exitosamente la arteria culpable y utilizando, preferentemente, stent liberador de drogas e inhibidores de la GP IIb/IIIa durante el procedimiento (52).
Con la nueva incorporación del ensayo COMPLETE a la evidencia clínica que demostró la disminución en la recurrencia de infarto, las principales guías deberán analizar qué tipo de recomendación se otorgará a la revascularización completa, teniendo en cuenta que en el estudio se incluyeron pacientes de bajo riesgo y con lesiones pasibles de angioplastia, sin evidenciar un claro beneficio en la mortalidad.
Ensayos en proceso
Antes de la publicación del estudio COMPLETE, los ECA realizados carecían de poder para mostrar diferencias en los puntos finales “duros”.
A pesar de la aparición del nuevo ensayo, todavía hay aspectos que se deben evaluar, como por ejemplo si existe o no beneficio en la mortalidad cardiovascular, el momento de realizar la revascularización completa y el uso de FFR para guiar la revascularización.
Actualmente hay dos estudios en curso:
- El ensayo “Revascularización inmediata versus estadificada en pacientes con infarto agudo de miocardio y enfermedad multivaso (MULTISTARS AMI)” estima incluir a 700 pacientes y comparar la revascularización completa realizada en etapas (dentro de 19 a 45 días posteriores a la angioplastia primaria) versus revascularización completa en el procedimiento percutáneo inicial. El punto final primario es un combinado de muerte por todas las causas, infarto de miocardio no fatal, revascularización, hospitalización por insuficiencia cardíaca y ACV al año. La fecha estimada de finalización del estudio es junio de 2020 (54).
- Finalmente, el ensayo “Revascularizacion completa de vasos no culpables en IAMCEST guiada por FFR” (FULL REVASC trial) asignará al azar a los pacientes con IAMCEST (n = 4052) a revascularización del vaso no culpable guiada por FFR, ya sea de forma inmediata o por etapas versus tratamiento conservador. El estudio tiene el poder de detectar diferencias en la mortalidad por todas las causas e infarto al año, con fecha de estimación de finalización en junio de 2030 (55).
Discusión
A pesar de los resultados beneficiosos de los ensayos aleatorios y de varios metaanálisis a favor de la revascularización completa en pacientes con IAMCEST, aún persiste el debate sobre el tema. Las principales críticas se centran en la heterogeneidad de los ensayos y sus resultados, así como en la falta de poder de la mayoría de los ECA para demostrar beneficio en los puntos finales “duros” de mortalidad y re-infarto.
El tamaño de muestra de los ensayos fueron generalmente pequeños, siendo el más grande luego del COMPLETE, el ensayo COMPARE-ACUTE con 885 pacientes. Cada uno de los estudios tuvo diferentes diseños. Por ejemplo, el momento de la angioplastia al vaso no culpable fue distinto: algunos lo realizaron durante el procedimiento inicial
(PRAMI, HELP-AMI), otros en diferido (DANAMI3-PRIMULTI, Ghani y cols, PRAGUE-13, COMPLETE) o efectuaron ambas estrategias (CvLPRIT, COMPARE-AGUTE, Hamza y cols, Politi y cols). En la revascularización por etapas, el momento de la intervención también varió desde dentro de las 72 horas del evento agudo (Hamza y cols), en cualquier momento antes del egreso hospitalario (CvLPRIT, COMPARE-AGUTE, COMPLETE), o hasta 60 días después del procedimiento inicial (Ghani y cols, Politi y cols, PRAGUE-13, COMPLETE). Solo el ensayo de Politi y cols estudió los resultados dentro de tres estrategias paralelas: RVC, RMV dentro del procedimiento inicial y por etapas.
Los criterios para la revascularización del vaso no culpable fueron diferentes, y variaron desde la evaluación angiográfica ≥50% de estenosis (PRAMI), ≥70% de estenosis (CvLPRIT, Politi y cols, PRAGUE-13, COMPLETE), ≥80% de estenosis (Hamza y cols), y según la medición del FFR (DANAMI3-PRIMULTI, COMPARE-ACUTE, Ghani y cols).
La medición angiográfica de la severidad de las lesiones coronarias no culpables en IAMCEST puede ser difícil de determinar debido a la variabilidad inter-observador. En los ensayos DANAMI3-PRIMULTI y COMPARE-ACUTE se ha demostrado que el FFR es superior a la evaluación angiográfica para guiar la angioplastia, ya que la mitad de las lesiones con >50% de estenosis dieron como resultado mediciones de FFR que no fueron hemodinámicamente significativas y no fueron revascularizadas. Es interesante que estos dos estudios mostraron una disminución en los resultados combinados en el grupo RMV que fue dada principalmente por disminución de la revascularización, mientras que los estudios sin FFR (es decir, ensayos PRAMI, CvLPRIT, COMPLETE) mostraron una disminución del punto final combinado, con diferentes resultados en los puntos individuales.
A su vez, es probable que algunas lesiones angiográficamente significativas pero con un FFR mayor a 0,80 puedan tener características morfológicas de placas vulnerables a la ruptura con un riesgo aumentado de desarrollar eventos coronarios agudos. Por lo tanto aún no queda claro el impacto del FFR en este tipo de pacientes.
Asimismo, las técnicas de angioplastia también han cambiado con el correr del tiempo con diferencias entre los ensayos más antiguos y los más contemporáneos, como por ejemplo, en los primeros trabajos (Ghani y cols, Politi y cols) se usaron menor cantidad de stents liberadores de drogas (<25%). A la vez, los primeros ensayos eran más pequeños, con poco poder estadístico y bajo número de eventos.
Dada la naturaleza abierta de estos ensayos, el conocimiento de las lesiones obstructivas no culpables puede sesgar a los operadores hacia la realización de procedimientos futuros de revascularización en la cohorte de RVC.
El ensayo COMPARE-ACUTE intentó resolver este problema cegando los resultados de FFR a los médicos tratantes pero no así los resultados angiográficos, por lo cual un porcentaje de pacientes recibió revascularización del vaso no culpable en el grupo de RVC.
En dos estudios (CvLPRIT y PRAMI) la proporción de pacientes que abandonaron los ensayos podrían haber aumentado el riesgo de sesgo de desgaste (attrition bias). Además, la terminación temprana de un estudio debido a una diferencia significativa entre los grupos (PRAMI), también pudo haber sobrestimado los beneficios.
Los riesgos de realizar RMV en pacientes con IAMCEST incluyen un procedimiento más prolongado, la infusión mayor volumen de contraste y posibles complicaciones con desarrollo de isquemia durante la revascularización del vaso no culpable. Hubo cinco ensayos que evaluaron la seguridad del procedimiento como punto final secundario
(Hamza y cols, CvLPRIT, COMPARE-ACUTE, DINAMI3-PRIMULTI y COMPLETE). Sin embargo, no hubo diferencias en las complicaciones, incluyendo ACV, sangrado y nefropatía inducida por contraste. La tasa de complicaciones en cada grupo tendió a ser baja a lo largo de estos estudios. En oposición, los estudios observacionales han sugerido un aumento en la mortalidad en aquellos con revascularización inmediata de vaso no culpable, pudiendo deberse principalmente a que eran pacientes de mayor riesgo (pacientes con insuficiencia cardíaca o en shock cardiogénico).
Como ya hemos visto, el momento óptimo de revascularización completa, sigue siendo un tema indefinido. La mayoría de los estudios observacionales que compararon la revascularización en diferido con revascularización en el procedimiento inicial han sugerido la superioridad de la revascularización por etapas. Sin embargo, los ensayos clínicos no se han centrado en comparar los diferentes momentos para realizar revascularización completa. Dado que el tiempo de revascularización no culpable varió enormemente en los ensayos, se necesitan más datos para examinar este punto.
A pesar de la heterogeneidad de los estudios y los puntos finales, de manera global los ECA han demostrado cierta superioridad a favor de la revascularización completa. Previo al desarrollo del ensayo COMPLETE, los ECA que brindaron la mayor evidencia clínica para evaluar estas estrategias no habían tenido el poder necesario para demostrar beneficios en los puntos finales de mortalidad cardiovascular e infarto.
Si bien en el ensayo COMPLETE el tratamiento de las lesiones no culpables ha demostrado reducción del riesgo del punto combinado de mortalidad cardiovascular e infarto, fue principalmente debido a una disminución en la tasa de re-infarto, sin evidenciar diferencias entre ambas estrategias en la mortalidad cardiovascular. Es importante destacar que a pesar de que el riesgo de re-infarto fue significativamente menor, evidentemente no fueron eventos graves ya que no se vio reflejado en la reducción de la mortalidad. Esto puede deberse a una falta de diferencia real o que hace falta mayor seguimiento en el tiempo de estos pacientes.
Es conveniente resaltar que los resultados de estos ensayos citados no se pueden extrapolar a pacientes más graves (inestables hemodinamicamente o en shock cardiogénico), ya que no fueron incluidos en estos trabajos.
Conclusión
Los ensayos randomizados publicados en los últimos años han presentado un beneficio global en la estrategia de revascularización completa en pacientes con IAMCEST que ha llevado a actualizaciones de las guías. Estos estudios reflejan una práctica clínica más contemporánea en la que el uso de stent liberadores de drogas, acceso radial y el uso de inhibidores de P2Y12 más efectivos ha mejorado los resultados clínicos y reducido las complicaciones relacionadas con el procedimiento.
Es importante destacar que en los ECA desarrollados, no se ha determinado si el objetivo de la revascularización completa debe ser el tratamiento de lesiones relacionadas con isquemia o placas vulnerables propensas a ruptura y trombosis.
Definir una estrategia común para todos los pacientes con IAMCEST y con enfermedad de múltiples vasos es un desafío ya que estos pacientes son extremadamente diferentes, y cualquier estrategia de revascularización debe individualizarse en función de las características clínicas y de la lesión en cuestión.
Realizar angioplastia de las lesiones no culpables no es una decisión fácil de llevar a cabo ya que existen una gran cantidad de variables a tener en cuenta: angiográficas (como el número de vasos afectados, severidad, localización, existencia de colaterales, complejidad), los múltiples escenarios clínicos (estabilidad hemodinámica, Killip y Kimball, función renal, riesgo de sangrado) y el contexto asistencial (personal capacitado, horario en el que se realiza el procedimiento, material del cual se dispone).
Como resultado final, el análisis sistemático realizado demostró que:
- Disminuye, sin duda, el requerimiento de nueva revascularización.
- Reduce la incidencia de infarto, siendo esta conclusión atribuible al estudio Complete.
- Sin impactos en la mortalidad global y cardiovascular, ni en el punto final de seguridad (sangrado).
Por el momento una opción razonable sería incorporar el juicio clínico y evaluar cada caso en particular.
Pacientes similares a los incluidos en los ECA podrían ser los que mayor beneficio a largo plazo obtengan con la RMV (hemodinamicamente estables, con lesiones coronarias significativas tanto por medición angiográfica como por FFR, de bajo riesgo, con lesiones pasibles de revascularización).
Las grandes guías requerirán más información de nuevos estudios randomizados que evalúen principalmente el efecto en los eventos duros y el tiempo óptimo de la realización de esta estrategia para definir finalmente una conducta.
Bibliografía
- Khera S, Kolte D, Palaniswamy C, Mujib M, Aronow WS, Singh T, et al. ST-elevation myocardial infarction in the elderly–temporal trends in incidence, utilization of percutaneous coronary intervention and outcomes in the United States. Int J Cardiol 2013; 168: 3683-90.
- Muller D, Topol EJ, Ellis SG, Sigmon KN, Lee K, Califf RM, et al. Multivessel coronary artery disease: a key predictor of short-term prognosis after reperfusion therapy for acute myocardial infarction. Thrombolysis and Angioplasty in Myocardial Infarction (TAMI) Study Group. Am Heart J 1991; 121: 1042-9.
- Jaski BE, Cohen JD, Trausch J, Marsh DG, Bail GR, Overlie PA, et al. Outcome of urgent percutaneous transluminal coronary angioplasty in acute myocardial infarction: comparison of single-vessel versus multivessel coronary artery disease. Am Heart J 1992; 124: 142733.
- Sorajja P, Gersh BJ, Cox DA, Mc Laughlin MG, Zimetbaum P, Costantini C, et al. Impact of multivessel disease on reperfusion success and clinical outcomes in patients undergoing primary percutaneous coronary intervention for acute myocardial infarction. Eur Heart J 2007;28: 1709-16.
- Choi, SY, Mintz GS. What Have We Learned About Plaque Rupture in Acute Coronary Syndromes? Curr Cardiol Rep. 2010; 12: 338–343.
- Pundziute G, Schuijf J, Jukema Jw, Decramer I, Sarno G, Vanhoenacker P. Evaluation of plaque characteristics in acute coronary syndromes: Non-invasive assessment with multislice computed tomography and invasive evaluation with intravascular ultrasound radiofrequency data analysis. European Heart Journal. 2008; 29: 2373–2381.
- Park DW, Clare RM, Schulte PJ, Pieper KS, Shaw LK, Califf RM, et al. Extent, location, and clinical significance of non-infarct-related coronary artery disease among patients with ST-elevation myocardial infarction. JAMA – Journal of the American Medical Association. 2014; 312: 2019-2027.
- Andries G, Khera S, Timmermans RJ, Aronow WS. Complete versus culprit only revascularization in st-elevation myocardial infarction-a perspective on recent trials and recommendations. Journal of Thoracic Disease. 2017; 9: 2159-2167.
- Lu DY, Zhong M, Feldman DN. Complete Versus Culprit-Only Revascularization in STEMI: a Contemporary Review. Current Treatment Options in Cardiovascular Medicine. 2018; 20:41.
- Pomés Iparraguirre HA, Navarro Estrada JL. Infarto agudo de miocardio. ProSAC. 2009; 4; 1-34.
- Muller JE, Tofler GH, Stone PH. Circadian variation and triggers of onset of acute cardiovascular disease. Circulation 1989; 79(4):733-43.
- Narula J, Nakano M, Virmani R, Kolodgie FD, Petersen R, Newcomb R, et al.
- Histopathologic Characteristics of Atherosclerotic Coronary Disease and Implications of the Findings for the Invasive and Noninvasive Detec- tion of Vulnerable Plaques. J Am Coll Cardiol. 2013;61(10):1041–51
- Raudales JC, Zago AC, Casco MF, Bortolini MA, Flores IV. Pathophysiology Of The Vulnerable Atherosclerotic Coronary Plaque And Acute Coronary Syndromes. Rev Med Hondur. 2015; 8: 57-65.
- Arroyo-Espliguero R, Avanzas P, Cosín-Sales J, Aldama G, Pizzi C, Kaski JC. C-reactive protein elevation and disease activity in patients with coronary artery disease. European Heart Journal. 2014; 25: 401-408.
- Chierchia SL. Inflamación y síndrome coronario agudo. Revista Española de Cardiologia. 2001; 54: 1135-1140
- Halkin A, Singh M, Nikolsky E, Grines CL, Tcheng JE, Garcia E, et al. Prediction of mortality after primary percutaneous coronary intervention for acute myocardial infarction:
- The CADILLAC risk score. Journal of the American College of Cardiology. 2005; 45: 13971405.
- Shah A, French W. Culprit-Only Artery Versus Multivessel Disease En: Clinical Guide to Primary Angioplasty; Spinger Link. 2013; p 126-130.
- Cavender MA, Milford-Beland S, Roe MT, Peterson ED, Weintraub WS, Rao SV. Prevalence, Predictors, and In-Hospital Outcomes of Non-Infarct Artery Intervention During Primary Percutaneous Coronary Intervention for ST-Segment Elevation Myocardial Infarction (from the National Cardiovascular Data Registry). American Journal of Cardiology; 2009; 104: 507-513.
- Iqbal MB, Nadra IJ, Ding L, Fung A, Aymong E, Chan AW, et al. Culprit vessel versus multivessel versus in- hospital staged intervention for patients with ST- segment elevation myocardial infarction and multivessel disease: stratified analyses in high-risk patient groups and anatomic subsets of nonculprit disease. JACC Cardiovasc Interv. 2017; 10:11–23.
- Iqbal MB, Ilsley C, Kabir T, Smith R, Lane R, Mason M, et al. Culprit vessel versus multivessel intervention at the time of primary percutaneous coronary intervention in patients with ST-segment-elevation myocardial infarction and multivessel disease: realworld analysis of 3984 patients in London. Circ Cardiovasc Qual Outcomes. 2014; 7: 936– 43.
- Hannan EL, Samadashvili Z, Walford G, Holmes DR Jr, Jacobs AK, Stamato NJ, et al. Culprit vessel percutane- ous coronary intervention versus multivessel and staged percutaneous coronary intervention for ST- segment elevation myocardial infarction patients with multivessel disease. JACC Cardiovasc Interv. 2010; 3: 22–31.
- Bauer T, Zeymer U, Hochadel M, Mollmann H, Weidinger F, Zahn R, et al. Prima-vista multi-vessel percutaneous coronary intervention in haemodynam- ically stable patients with acute coronary syndromes: analysis ofover 4.400 patients in the EHS-PCI registry. Int J Cardiol. 2013; 166: 596–600.
- 23Toma M, Buller CE, Westerhout CM, Fu Y, O’Neill WW, Holmes DR Jr, et al. Non-culprit coronary artery percutaneous coronary intervention during acute ST- segment elevationmyocardial infarction: insights from the APEX-AMI trial. Eur Heart J. 2010; 31:1701–7.
- Vlaar PJ, Mahmoud KD, Holmes DR Jr, Van Valkenhoef G, Hillege HL, Van Der Horst IC, et al. Culprit vessel only versus multivessel and staged percutaneous coronary intervention for multivessel disease in patients presenting with ST-segment elevation myocardial infarction: a pairwise and network meta-analysis. J Am Coll Cardiol. 2011; 58: 692–703.
- Bangalore S, Kumar S, Poddar KL, Ramasamy S, Rha SW, Faxon DP. Meta-analysis of multivessel coronary artery revascularization versus culprit-only revasculari- zation in patients with ST-segment elevation myocar- dial infarction and multivessel disease. Am J Cardiol. 2011;107:1300–10
- Di Mario C, Sansa M, Airoldi F, Sheiban I, Manari A. Petronio A. Single vs multivessel treatment during primary angioplasty: Results of the multicentre randomised HEpacoat™ for cuLPrit or multivessel stenting for Acute Myocardial Infarction (HELP AMI) Study. International Journal of Cardiovascular Interventions. 2004; 6: 128-133.
- Politi L, Sgura F, Rossi R, Monopoli D, Guerri E, Leuzzi C, et al. A randomised trial of target-vessel versus multi-vessel revascularisation in ST-elevation myocardial infarction: Major adverse cardiac events during long-term follow-up. Heart; 2010; 96: 662-667.
- Ghani a, Dambrink JHE, van’t Hof AWJ, Ottervanger JP, Gosselink ATM, Hoorntje JCA. Treatment of non-culprit lesions detected during primary PCI: Long-term follow-up of a randomised clinical trial. Netherlands Heart Journal; 2012; 9: 347-353.
- Hlinomaz O, Poloková K, Lehar F, Vekov T, Petkov R, Stoynev M, et al. Multivessel coronary disease diagnosed at the time of primary PCI for STEMI: complete revascularization versus conservatie strategy. PRAGUE 13 trial. Unpublished Available at http://sbhci.org.br/ wp-content/uploads/2015/05/PRAGUE-13-Trial.pd.
- Hamza M, Elgendy IY, Mahmoud AN. A Randomized Trial of Complete Versus CulpritOnly Revascularization during Primary Percutaneous Coronary Intervention in Diabetic Patients with Acute ST Elevation Myocardial Infarction and Multi Vessel Disease. Journal of Interventional Cardiology; 2016; 29: 241-247.
- Wald DS, Morris JK, Wald NJ, Chase AJ, Edwards RJ, Hughes LO, et al. Randomized trial of preventive angioplasty in myocardial infarction (PRAMI). New England Journal of Medicine; 2013; 369: 1115-1123.
- Gershlick AH, Khan JN, Kelly DJ, Greenwood JP, Sasikaran T, Curzen N, et al. Randomized trial of complete versus lesion-only revascularization in patients undergoing primary percutaneous coronary intervention for stemi and multivessel disease: The CvLPRIT trial. Journal of the American College of Cardiology; 2015; 10: 963-972.
- Engstrøm T, Kelbæk H, Helqvist S, Høfsten DE, Kløvgaard L, Holmvang L, et al. Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI-3 – PRIMULTI): An openlabel, randomised controlled trial. The Lancet; 2015; 386: 665-671.
- Smits PC, Abdel-Wahab M, Neumann FJ, Boxma-de Klerk BM, Lunde K, Schotborgh CE. Fractional Flow Reserve–Guided Multivessel Angioplasty in Myocardial Infarction. New England Journal of Medicine; 2017; 376: 1234-1244.
- Bhatt D. Do we really know the CvLPRIT in myocardial infarction? or just stent all lesions? Journal of the American College of Cardiology; 2015; 65: 973-975.
- Elgendy IY, Mahmoud AN, Kumbhani DJ, Bhatt DL, Bavry AA, Complete or Culprit-Only Revascularization for Patients With Multivessel Coronary Artery Disease Undergoing Percutaneous Coronary Intervention: A Pairwise and Network Meta-Analysis of Randomized Trials. JACC: Cardiovascular Interventions. 2017; 10: 315-324.
- Bravo C, Bhatt D, Kataria R, Faxon D, Ohman E, et al. Complete versus culprit-only revascularisation in ST elevation myocardial infarction with multi-vessel disease (Review). Cochrane Database of Systematic Reviews; 2017, Issue 5. Art. No.: CD011986.
- Bangalore S, Toklu B, Wetterslev J. Complete Versus Culprit-Only Revascularization for ST-Segment–Elevation Myocardial Infarction and Multivessel Disease A Meta-Analysis and Trial Sequential Analysis of Randomized Trials. Circ Cardiovasc Interv. 2015; 8: e002142.
- Pandit A, Aryal MR, Aryal Pandit A, Hakim FA, Smith G, Mainili NR, et al. Preventive PCI versus culprit lesion stenting during primary PCI in acute STEMI: a systematic review and meta-analysis. Open Heart 2014;1:e000012.
- Nagaraja S, Ooi SY, Nolan J, Large A, De Belder M, Ludman P, et al. Impact of Incomplete Percutaneous Revascularization in Patients With Multivessel Coronary Artery Disease: A Systematic Review and Meta-Analysis. J Am Heart Assoc. 2016; 5: e004598.
- Wang CH, Zhang SY, Jin XF. Complete revascularization versus culprit-only revascularization in ST-segment elevation myocardial infarction and multivessel disease patients undergoing primary percutaneous coronary intervention: A meta-analysis and trial sequential analysis. Int J Cardiol; 2017; 228: 844-52
- Kornowski R, Mehran R, Dangas G, Nikolsky E, Assali A, Claessen BE, et al. Prognostic impact of staged versus “one-time” multivessel percutaneous intervention in acute myocardial infarction: Analysis from the HORIZONS-AMI (Harmonizing Outcomes with Revascularization and Stents in Acute Myocardial Infarction) trial. Journal of the American College of Cardiology; 2011; 58: 704-711.
- Tarantini G, D’Amico G, Brener SJ, Tellaroli P, Basile M, Schiavo A, et al. Survival After Varying Revascularization Strategies in Patients With ST-Segment Elevation Myocardial Infarction and Multivessel Coronary Artery Disease: A Pairwise and Network MetaAnalysis. JACC: Cardiovascular Interventions. 2016; 9: 1765-1776.
- Shah NR, Al-Lamee R, Davies, J. Fractional flow reserve in acute coronary syndromes: A review. IJC Heart and Vasculature; 2014; 5: 20-25.
- Prasad A, Gersh BJ. Management of microvascular dysfunction and reperfusion injury. Heart. 2005; 91: 1530-32.
- Kramer CM, Rogers WJ, Theobald TM, Power TP, Petruolo S, Reichek N. Remote noninfarcted región dysfunction soon after first anterior myocardial infarction. A magnetic resonance tagging study. Circulation; 1996; 94: 660-6.
- Ntalianis A, Sels JW, Davidavicius G, Tanaka N, Muller O, Trana C, et al. Fractional flow reserve for the assessment of nonculprit coronary artery stenoses in patients with acute myocardial infarction. JACC: Cardiovascular Interventions; 2010; 3: 1274-1281.
- Gara PTO, Kushner FR, Ascheim DD, Casey DE, Mina K, Lemos J, et al. 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013; 127: e362-e425.
- Windecker S, Kolh P, Alfonso F, Collet JP, Cremer J, et al. 2014 ESC/EACTS guidelines on myocardial revascularization: the task force on myocardial revascularization of the European Society ofCardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J. 2014; 35: 2541–619.
- Levinne GN, Bates E, Blankenship JC, Bailey SR, Bittl J, Cercek B, et al. 2015 ACC/AHA/SCAI Focused Update on Primary Percutaneous Coronary Intervention for Patients With ST-Elevation Myocardial Infarction: An Update of the 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention and the 2013 ACCF/AHA Guideline for the management of ST-Elevation Myocardial Infarction. Circulation. 2016; 133: e442-e443 51. Borja I, James S, Agewall S, Antunes M, Bucciarelli-Ducci C, Bueno H, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. European Heart Journal. 2018; 39: 119-177.
- Tajer CD, Lowenstein J, Trainini J, Thierer J, Toro D, Fernandez A y col. Consenso de infarto agudo de miocardio con elevación del segmento ST. Consenso de la Sociedad Argentina de Cardiología. Revista Argentina de Cardiologia. 2015; Vol 83, suplemento 4.
- Mehran R, Bainey KR, Nguyen H, Meeks B, Pasquale GD, Sendón JL, et al. Complete Revascularization with Multivessel PCI for Myocardial Infarction (COMPLETE trial). New England Journal of medicine; 2019; p 1-11.
- Stähli BE, Maier W. MULTivessel Immediate Versus STAged RevaScularization in Acute Myocardial Infarction -The MULTISTARS AMI Trial (MULTISTARS AMI). National Library of Medicine. 2019. Estudio en proceso.
- Bohm F, Rück A, Fossum E, Engstrøm T, Gudnasson T, Laine M, et al. Ffr-gUidance for compLete Non-cuLprit REVASCularization (FULL REVASC). National Library of Medicine . 2019. Estudio en proceso.
- Mehta SR, Wood DA, Meeks B, Storey RF, Mehran R, Bainey KR, et al. Design and rationale of the COMPLETE trial: A randomized, comparative effectiveness study of complete versus culprit-only percutaneous coronary intervention to treat multivessel coronary artery disease in patients presenting with ST-segment elevation myocardial infarction. Am Heart J; 2019; 215:157-166.
Tablas y figuras
Tabla 1. Análisis sistemático de los ECA: Mortalidad por todas las causas.


Tabla 2: Análisis sistemático de los ECA: Mortalidad cardiovascular.

Figura 2:Forest plot de mortalidad cardiovascular.

Tabla 3. Análisis sistemático de los ECA: Infarto agudo de miocardio

Figura 3: Forest plot de Infarto agudo de miocardio.

Tabla 4. Análisis sistemático de ECA: Revascularización.

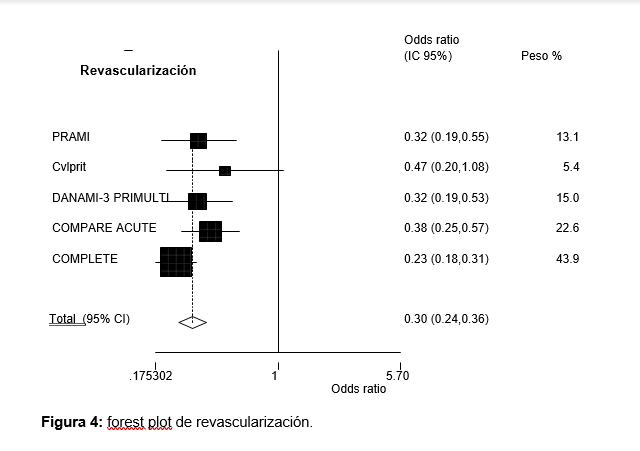
Tabla 5. Análisis sistemático de ECA: Sangrado







