Lie ØH, Klaboe LG, Dejgaard LA, et al. Cardiac phenotypes and markers of adverse outcome in elite athletes with ventricular arrhytmias. JACC Cardiovasc Imaging 2021;14(1):148-158.
En los últimos años se ha descripto que en ciertos atletas de alto rendimiento, por factores de susceptibilidad aún desconocidos, el estímulo deportivo intenso podría conducir al desarrollo de un fenotipo maladaptativo diferente al “corazón de atleta”, con cambios cardíacos irreversibles y desarrollo de un perfil arritmogénico sin una causa clara más allá de altas dosis de ejercicio.
Aun con las limitaciones propias de un estudio unicéntrico de corte trasversal, controlado y retrospectivo, este es uno de los estudios más importantes que se propone describir las características distintivas y marcadores de riesgo en un grupo de atletas competitivos aparentemente sanos con presencia de arritmias ventriculares (n=43) vs grupo de atletas sanos sin arritmias (n=30, en su mayoría ciclistas de alto rendimiento y esquí), mediante una evaluación exhaustiva que incluye electrocardiograma (ECG), Holter, ergometría, ecocardiograma, cardio-RM, CCG, angio-TC coronaria y pruebas genéticas.
Todos los atletas fueron desacondicionados durante al menos 6 semanas antes de la evaluación (excepto en el grupo sanos) y se excluyeron los pacientes con comorbilidad cardiopulmonar, mutaciones genéticas asociadas con miocardiopatía o canalopatía, antecedentes familiares de muerte súbita (MS) o enfermedad cardíaca prematura, o que informaran el uso de fármacos para mejorar el rendimiento deportivo. Se incluyeron además aquellos atletas que cumplían solo criterios diagnósticos menores en dimensiones o función para miocardiopatía arritmogénica (MA) según la Task Force de 2010, solo si era justificable por una dosis alta de ejercicio en ausencia de antecedentes o mutación genética asociada con la MA. Se definió como eventos arrítmicos serios o potencialmente mortales a MS reanimada, TV sostenida, FV o terapia apropiada de CDI.
Las características basales de ambos grupos (arritmias vs sanos) fueron similares en edad, sexo, dosis y duración de ejercicio, aunque hubo menor índice de masa corporal en el grupo de atletas sanos, y mayor frecuencia de extrasístoles ventriculares en el Holter (n/24hs 135 vs 5; p=0,007) y de ECG anormal (16% vs 4%; p=0,03) en el grupo de atletas con arritmias.
La duración media del ejercicio acumulada fue de 9893 horas (RIC: 4342 a 19550 h).Se halló una modesta correlación general entre el diámetro del TSVD y la duración acumulada del ejercicio (beta 0,54; p <0,001), independiente de la edad (beta ajustado 0,48; p <0,001) lo que sugiere una relación dosis-respuesta.
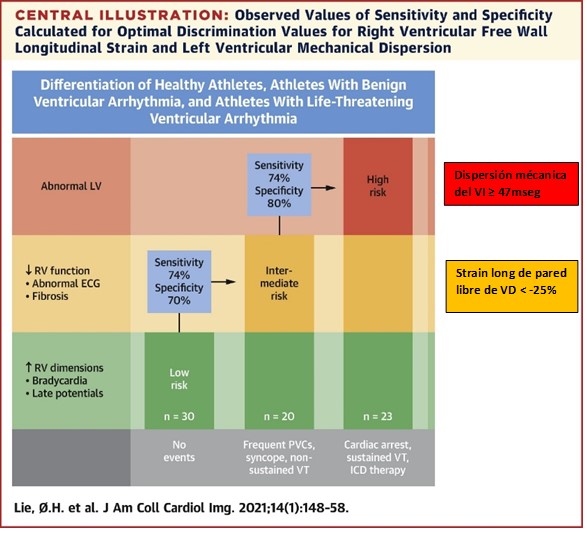
Respecto al ecocardiograma se observaron dimensiones de ventrículo derecho (VD) similares, pero volúmenes de ventrículo izquierdo (VI) y aurícula izquierda (AI) mayores en el grupo de atletas sanos vs el grupo de atletas con arritmias. Este último grupo mostró una fracción de eyección del VI marginalmente más baja (56% vs 59%; p=0,03); mayor relación e/e´ (7 vs 5,5; p=0,002); menor TAPSE (23 vs 27mm; p=0,003); peor Strain longitudinal de pared libre de VD (SLplVD -22,9 vs -26,6%; p<0,001). Si bien se obtuvieron cifras dentro del rango de la normalidad, se propone utilizar al SLplVD con valor de corte de -25% (ABC: 0,73; IC95%: 0.62-0.82) para identificar con una sensibilidad de 74% y especificidad del 70% a los atletas con presencia de arritmias (ver ilustración central).
Por otro lado, el grupo de atletas con arritmias mostró en la cardio-RM una mayor presencia de realce tardío de gadolinio (8% vs 1%; p=0,03), y una menor FEVD (48% vs 52%; p=0,04) aunque dentro del rango normal.
El estudio se diseñó con adjudicación de eventos de forma retrospectiva entre los años 2007 y 2017. El 53% (n=23) de los atletas desarrolló eventos arrítmicos potencialmente mortales; 9 MS reanimada, 6 terapia adecuada de CDI y 8 TVS en Holter (el 43% de ellos con morfología de BRI y eje superior), reportando el evento a los 0,5 años de la inclusión (IC:0-3.3 años). El 47% restante (20 aletas) presentaron TVNS (n=8), síncope (n=5) o EV frecuentes en Holter (n=7).
Los atletas que presentaron eventos arrítmicos malignos se caracterizaron por tener ECG basal anormal (16% vs 8%; p=0,03), menor Strain longitudinal global del VI (-17.1 vs -18.8%; p=0,04), peor dispersión mecánica del VI valorada mediante el desvío estándar del tiempo hasta el pico sistólico del Strain (DMVI: 60 vs 41 ms; p<0.001), menor TAPSE (20 vs 26mm; p<0,001), menor cambio del área fraccional de VD (35 vs 40%; p=0,04) y sin diferencias en SLplVD (22,1 vs 23,7%; p=NS) o sincronía de VD. No hubo diferencias en parámetros valorados por cardio-RM como volúmenes de VI, FEVI, FEVD o realce tardío de gadolinio en el grupo con presencia vs ausencia de eventos arrítmicos serios.
En el análisis multivariado, la DMVI fue el único marcador independiente de eventos arrítmicos graves (OR: 2,2; IC95%: 1,1 a 4,8 por cada incremento de 10 ms; p=0,03) y se propone el valor de corte en ≥47 ms (ABC: 0,81; IC95%: 0,68 a 0,94) con una sensibilidad del 74% y una especificidad del 80%. No obstante, las diferencias absolutas fueron pequeñas y es probable que ningún parámetro tenga utilidad clínica como herramienta independiente.
Existen ciertos factores que podrían influir en los resultados de este estudio: los grupos comparados tuvieron diferencias basales en varios aspectos como contextura física, tipo de deporte, tratamiento farmacológico (presente en el grupo con arritmias), desacondicionamiento (no realizada en atletas sanos), y que fueron evaluados con resonadores de diferentes capacidad y tecnología. La angiografía coronaria fue realizada por indicación médica (no a todos).
Para concluir, los autores destacan el valor de las imágenes cardíacas multimodales en el diagnóstico de los atletas de elite que presentan arritmias ventriculares. Sugieren que el remodelado persistente del VD con dilatación y deterioro sutil de la función sistólica aún después del desacondicionamiento podría significar, como plantean otros estudios previos, una maladaptación al ejercicio (que simula a la MA) e implica un mayor riesgo de arritmias ventriculares, por factores aún desconocidos. Del mismo modo que ocurre en la MA, la afectación del VI se asoció con eventos arrítmicos potencialmente mortales y podría ser un marcador de riesgo adicional en atletas.
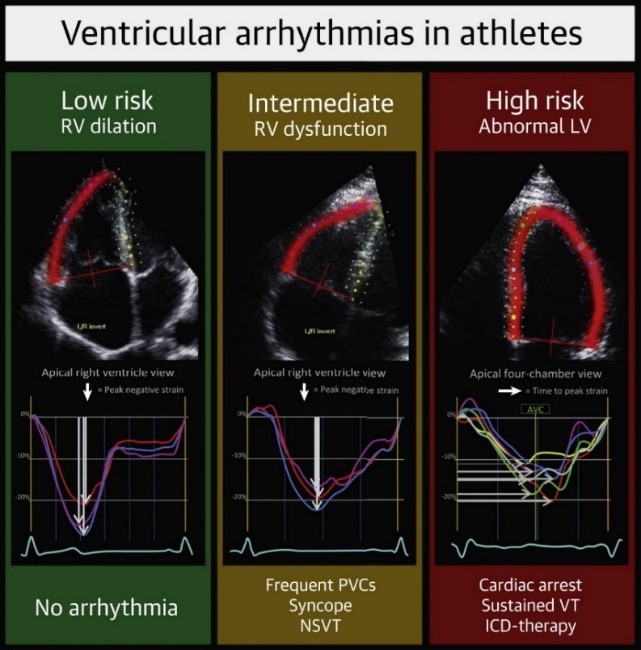
Figura 1. Curvas de Strain longitudinal por ecocardiografía en deportistas con y sin arritmias ventriculares.
Curvas de deformación ecocardiográfica de un atleta sano con ventrículo derecho (VD) dilatado y Strain longitudinal normal (panel verde), un atleta con arritmia ventricular y VD dilatado con Strain longitudinal anormal (panel amarillo) y un atleta con arritmia ventricular potencialmente mortal y contracciones heterogéneas del ventrículo izquierdo (panel rojo).
Comentario
Según las guías europeas para deportistas con arritmias, los atletas que presentan EV con buen pronóstico se caracterizan por tener: QRS con morfología BRI + eje inferior (origen TSVD o TSVI) o patrón BRD angosto (<130mseg, origen fascicular), atenuación o desaparición con el ejercicio, baja complejidad (monomorfas o aisladas), intervalo de acoplamiento prolongado (ausencia de fenómeno de R sobre T), sin síntomas o antecedente familiar de MS, ECG sin anormalidades e imágenes cardíacas normales1. En este estudio los atletas que desarrollaron arritmias malignas tenían en su mayoría TV con morfología BRI + eje superior y durante el ejercicio, ECG basal anormal y alteraciones sutiles en el ecocardiograma fundamentalmente en la valoración por Strain, sin embargo llamativamente no hubo diferencias en la cardio-RM.
La evaluación del Strain por Speckle-tracking en ecocardiografía ofrece la posibilidad de incrementar la sensibilidad en la detección de cardiopatía estructural. Para VD, el SLplVD ha mostrado ser un parámetro factible, reproducible y con valor pronóstico en muchas entidades, proponiéndose como valor de corte normal -23%2. Por ejemplo, en un estudio sobre familiares de primer grado de pacientes con MA, un SLplVD normal predice ausencia del desarrollo de enfermedad en 4 años, y también su alteración fue predictor de progresión a enfermedad3. Del mismo modo, el Strain longitudinal global de VI y más recientemente el estudio de la dispersión mecánica del VI por Strain han mostrado su valor pronóstico arrítmico en diferentes cardiopatías4,5. Aunque su uso se encuentra poco extendido, en este estudio la DMVI ha mostrado ser un novedoso factor de evolución adversa en un grupo de atletas sin cardiopatía.
Finalmente, en consonancia con estudios previos, se plantea la hipótesis del desarrollo de una “cardiopatía por ejercicio” con fenotipo arritmogénico en atletas con altas dosis de entrenamiento, sin embargo, por el diseño de este trabajo no se puede confirmar que estos atletas pertenezcan a dicha entidad y se necesitan más investigaciones para confirmar estos hallazgos.
Bibliografía
- Heidbuchel H, Arbelo E, D’Ascenzi F, Borjesson M, Boveda S, Castelletti S, et al. Recommendations for participation in leisure-time physical activity and competitive sports of patients with arrhythmias and potentially arrhythmogenic conditions. Part 2: ventricular arrhythmias, channelopathies, and implantable defibrillators. Europace 2021;23(1):147-148.
- Zaidi A, Knight DS, Augustine DX, Harkness A, Oxborough D, Pearce K et al. Echocardiographic assessment of the right heart in adults: a practical guideline from the British Society of Echocardiography. Echo Res Pract 2020;7(1):G19-G41.
- Mast TP, Taha K, Cramer MJ, Lumens J, van der Heijden JF, Bouma BJ et al. The Prognostic Value of Right Ventricular Deformation Imaging in Early Arrhythmogenic Right Ventricular Cardiomyopathy. JACC Cardiovasc Imaging2019;12(3):446-455.
- Haugaa KH, Smedsrud MK, Steen T, Kongsgaard E, Loennechen JP, Skjaerpe T et al. Mechanical dispersion assessed by myocardial strain in patients after myocardial infarction for risk prediction of ventricular arrhythmia. JACC CardiovascImaging 2010;3(3):247-56.
- Kawakami H, Nerlekar N, Haugaa KH, Edvardsen T, Marwick TH. Prediction of Ventricular Arrhythmias With Left Ventricular Mechanical Dispersion: A Systematic Review and Meta-Analysis. JACC Cardiovasc Imaging 2020;13(2 Pt 2):562-572.
Autores: Dr. Rafael Zaugg / Dr. Diego Iglesias






